向山 厚(むかいやま・あつし)
福井県立大学 生物資源学部生物資源学科 准教授
和歌山県生まれ。2007年大阪大学大学院工学研究科物質・工学専攻博士課程修了。博士(工学)。自然科学研究機構分子科学研究所博士研究員、名古屋大学大学院理学研究科でCREST研究員を経て、12年自然科学研究機構分子科学研究所助教、13年総合研究大学院大学物理科学研究科助教(兼任)。23年より現職。専門はタンパク質科学、生物物理学。とくに生物時計のメカニズムを分子構造から調べている。
ショートムービーで見る研究のあらまし
INDEX
生物の体内時計は22億年前に誕生した!?
私たちが夜になると眠くなるのは、眠りを促すホルモンが出るからだ。夜更かしをしても朝には血圧が上がり、とりあえず目が覚める。渡り鳥は冬になると大陸から飛来し、桜は春になれば花が咲く。生物にはそんな生命活動に関わるさまざまな周期のリズムがあって、それをつかさどっているのが「体内時計」だ。とくに1日にあたる約24時間(概日)の周期を測る体内時計は「概日時計」と呼ばれる。ヒトを含むほ乳類から植物、微生物に至るまで多くの生き物がその時計をもっていて、「時計遺伝子」がつくりだす「時計タンパク質」が生理的なリズムを生み出しているのだ。
体内時計が動くしくみを、タンパク質の構造から研究しているのが向山先生だ。先生が調べているのはシアノバクテリアのタンパク質。2025年5月、約10年の研究を経て、概日時計を地球上で初めて獲得した生物は、22億年前のシアノバクテリアだと世界で初めて明らかにした。シアノバクテリアは、太古の地球で光と二酸化炭素を使って初めて酸素をつくり出した、単細胞の光合成生物だ。効率よく光合成を行うために、体内時計のしくみをいち早く獲得したと考えられている。
「シアノバクテリアの体内時計の中核となるのは、たった3種類のタンパク質です。私たちは、そのタンパク質の進化に注目して、現代のシアノバクテリアのタンパク質情報をもとに、太古の時計タンパク質を実験室で再現し、時計として働くかどうかを調べてみました。すると、22億年前に現れたシアノバクテリアの祖先が体内時計の機能を初めて地球上に生み出したとわかったんです」
興味深いことに、再現したシアノバクテリアの概日時計は、24時間ではなく20時間周期のリズムを刻んでいたという。22億年前の地球は自転が今より早く、1日は約20時間だったことが地質学などからわかっているが、まさにそのリズムが一致していたのだ。いったいどんな研究なのか、そもそも体内時計が時を刻むしくみとは? 体内時計の基本から詳しくうかがっていこう。
体内時計のしくみはどこまで解明されたのか
生物に体内時計があるということは、オジギソウが暗闇の中でも24時間周期で葉を開閉することから18世紀には確認されていた。1971年にはショウジョウバエの突然変異体を研究していたアメリカのシーモア・ベンザー(Seymour Benzer)博士が、体内時計に異常をきたしたハエを発見。その後、ベンザー博士の志を継いだ3人のアメリカ人研究者、マイケル・ロスバッシュ(Michael Rosbash)、ジェフリー・ホール(Jeffrey C. Hall)、マイケル・ヤング(Michael W. Young)が1984年にその原因遺伝子を発見し、“Period”と名付けた。この研究で3人は2017年にノーベル生理学・医学賞を受賞している。
以来、多くの研究者によって研究は進み、Periodだけでなく、TimelessやClock、Cycleなどの遺伝子が次々に報告され、マウスやヒトの時計遺伝子も発見された。時計遺伝子の転写・翻訳によるタンパク質の増減が、体内時計のリズムを生み出していることも明らかになった。
「科学技術の進展で体内時計が動くしくみはかなり明らかになってきました。でも、その時計がなぜ24時間周期で動くのかは、ほとんど明らかになっていなかったのです」と向山先生は言う。
つまり、時計の針が動く現象ばかり見ていて、時計の針が12時間で1周するしくみは研究が進んでいなかったのだ。そこに新たな発見をしたのが、名古屋大学理学研究科の近藤孝男(こんどう・たかお)教授(故人)だ。近藤教授は真核生物にしかないと思われていた体内時計が、原核生物であるシアノバクテリアにもあることを1993年に世界で初めて報告。その後、シアノバクテリアの細胞内に時計を刻む3つの遺伝子を発見、時計の“回転”にちなんでkaiA、kaiB、kaiCと名付けた。さらに2005年には遺伝子kaiA、kaiB、kaiCの翻訳産物である3種のKaiタンパク質と、エネルギー源であるATP(アデノシン三リン酸)を試験管内で混ぜると24時間の周期で振動することをScience誌に発表し、大きな注目を浴びた。
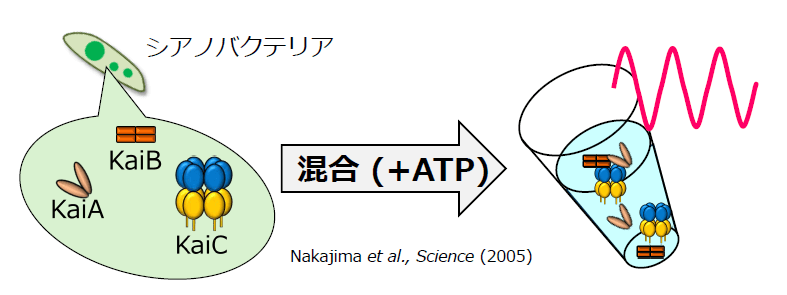
KaiA、KaiB、KaiCの3つのタンパク質とATPを混ぜると、試験管内で24時間のリズムを刻む。
「その後、私は近藤先生の研究室でKaiタンパク質の構造や24時間の周期を刻むしくみについて研究を進めることになりました。最古の体内時計を突き止めることができたのも、この発見があったからです」
そもそも向山先生は、学生時代まで生物に興味はなかったという。ばくぜんとモノづくりがしたいと、大阪大学工学部に進んだ。ところが1年の教養の生命科学工学授業で、タンパク質のおもしろさに目覚めたそうだ。
「物質としてのタンパク質の巧妙なしくみや構造に興味が湧いたんです。そして勉強を進めるうちに生物のタンパク質の多様性に惹かれるようになり、生物をタンパク質から調べてみようと考えました」
そこで同大学の金谷茂則(かなや・しげのり)先生の研究室に入り、火山や深海といった極限環境にすむ微生物のタンパク質を調べはじめた。
「たとえば火山にいる好熱性微生物のタンパク質は100℃になっても壊れません。一見、普通のタンパク質なのになぜ壊れないのか、そのメカニズムを物質としての興味から研究していました。しかし、生命現象を解明したいという思いもずっとありました。そんなとき、近藤先生が博士研究員を募集していることを知ったんです。またとないチャンスだと思って応募しました。それまで概日時計のことは一般的な知識しかなかったのですが、タンパク質の視点で概日時計のしくみを解き明かしてみたいと考えたのです」
ATPの分解反応速度が24時間のリズムを決める
向山先生が近藤研究室に入ったのは2010年。試験管内でシアノバクテリアの概日時計が再構成できるという研究が報告された後だ。向山先生は当時、近藤研究室の講師だった秋山修志(あきやま・しゅうじ)先生(現・分子科学研究所協奏分子システム研究センター長)のもとで、シアノバクテリアの時計タンパク質の構造や機能を化学や物理学の視点で調べることになった。大型放射光施設SPring-8*での数ナノメートルレベルでのX線解析や蛍光分光法などを使って、時計を動かす中心的な役割を持つKaiCの分子構造と動きを見ていったのだ。
*大型放射光施設SPring-8:太陽の100億倍もの明るさに達する「放射光」という光を使って、物質の原子・分子レベルでの形や機能を調べる事ができる研究施設。SPring-8の名前はSuper Photon ring-8 GeV(80億電子ボルト)に由来する。
一方、米国の研究者によって、KaiCはドーナツを2つ積み重ねたような二重のリング構造であることも明らかになった。しかし、形がわかっても、なぜ24時間周期のリズムを生み出せるのかは依然、謎のままだった。
「KaiCはおもしろいタンパク質で、自らのリン酸化と脱リン酸化を促す2つの機能に加えてATPase(エーティーピーエース)といって、水分子を使ってATPを分解する酵素の機能*を持っています。そして、ATPaseの働きに連動して、リングが大きく膨らんだり縮んだりを繰り返していることが私たちの研究で明らかになりました。まるで心臓の鼓動のように動くんです。さらにKaiAやKaiBは、鼓動を感知するとKaiCと付いたり離れたりする。この一連の動きが、シアノバクテリアの概日時計のリズムを生み出していたのです」
*ATPを分解する酵素の機能:ATPはアデノシンという物質に3つのリン酸基が結合した形をしている。ATP加水分解酵素であるATPaseの働きによって、リン酸基が外されて分解される。1つのリン酸基がはずれるごとに、約8kcal/molのエネルギーを放出する。ATPが生体のエネルギー通貨と呼ばれているのはこの働きによる。
Kaiタンパク質時計の反応サイクルの模式図
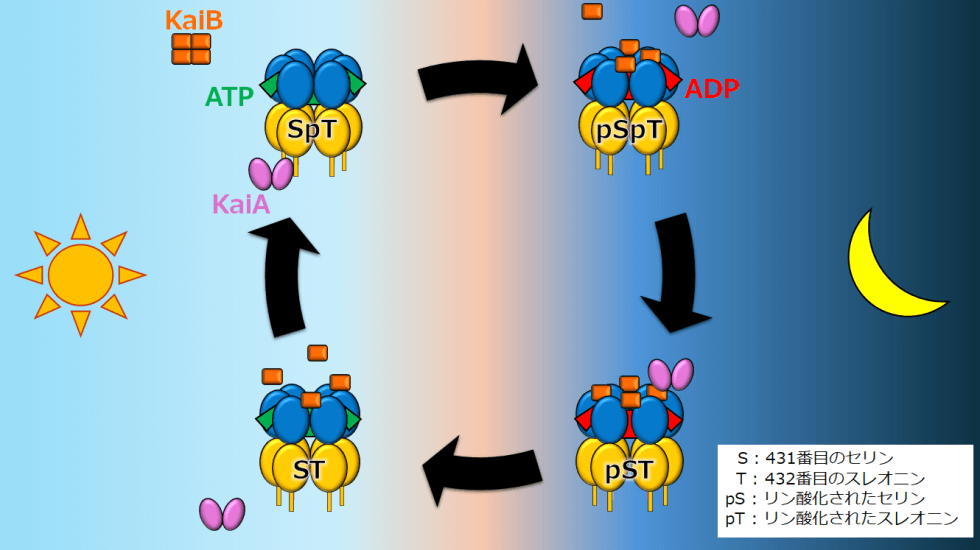
KaiCはドーナツを2つ重ねたような二重リング構造(図中、青と黄の部分)をとる。KaiCのATPaseやリン酸化・脱リン酸化の働きと連動して、リングの形状が膨張・伸縮を繰り返す。その鼓動がKaiAやKaiBを引き寄せられたり離れたりするタイミングの指針となり、反応サイクルを力強く安定に保っている。
2012年に分子科学研究所で研究グループを立ち上げた秋山教授のもとで、向山先生はシアノバクテリアの概日時計研究を深化させていった。
KaiCのATPaseが概日時計のリズムに深く関与していることがわかったので、その分解速度を詳しく調べてみた。
「それまでの実験から、1分子のKaiCが1日に加水分解するATPはわずか12個ということがわかっていました。これは温度変化の影響をほとんど受けません。筋肉の収縮では1分10個で1日に1万個のATPが、膜輸送では1分1万個で1日では1億個のATP個が分解されることと比べると、圧倒的に活性が低いのです。私たちは条件を整えてKaiCのATPaseの時間変化を高精度に測定したところ、振動成分が含まれることを突き止めました。この信号を解析したところ、24時間周期にほぼ合致する周波数(0.91回/day)であることがわかりました」
KaiCのアミノ酸配列を少し変えて、ATPaseの振動成分に含まれる周波数が2倍になるタンパク質をつくって周期を測ったところ、周期は12時間に。逆に振動成分の周波数が半分にとなったKaiCでは周期が48時間になった。つまり、KaiCの分子構造の中に概日時計の24時間を決める因子が刻み込まれていたのだ。
「タンパク質の構造研究では一瞬の変化をいかに捉えるかに苦労するのが常識なのに、時計タンパク質はゆっくりとした変化を3、4日追いかけなければなりません。温度が少しでも変わると結果に影響が出るなど、一定の環境を保つために苦労しました。でもこの遅さこそ、24時間という時間情報を生み出す鍵のはずだと研究を続けました。ATPを加水分解する際には結合したATPに水分子を近づける必要がありますが、結晶構造を解析してKaiCは水分子が非常に入りにくい構造であることもわかったのです」
一連の研究は2015年にScience誌に掲載された。

秋山研時代、人文字でKaiを表した写真。左端:古池美彦(ふるいけ・よしひこ)助教 右端:秋山修志教授。この3人で協力しあい、体内時計の進化の謎に迫った。
体内時計の進化のプロセスを試験管内で再現
KaiCタンパク質は24時間という地球の自転周期を宿していた。では生命はいつ、時計を獲得したのだろうか? そして昔の時計はどのくらいの速さで動いていたのだろう? KaiCタンパク質はシアノバクテリア以外のさまざまな原核生物も持っている。そこで向山先生たちが2015年ごろからチャレンジしたのが、体内時計の進化のシナリオを探る研究だった。
「まずシアノバクテリアを中心に、微生物や古細菌など現存する150種類の生物の時計タンパク質情報をデータベースから集めました。それをコンピュータに入力し、『祖先配列復元法』*という統計手法で系統樹をさかのぼり絶滅種のアミノ酸配列を推定していきます。さらに、系統樹**から7つの分岐点の生物を選び、アミノ酸配列から実際に時計タンパク質を合成して、試験管内でATPと混ぜてみたのです。私が主にタンパク質の調整や機能を調べ、分子科学研究所の古池美彦先生がタンパク質の構造解析を担当しました」
*祖先配列復元法:タンパク質を構成するアミノ酸の並び方は、太古から現在までのプロセスで変化し、多様化していく。その配列の類似性に基づいて、変化を逆算して進化を遡っていく手法。
**系統樹:生物同士の類縁関係(系統)を、推定される進化の道すじに従って描いた図。もとの幹から太い枝、小枝へと、多数の枝分れをもつ樹木の形にたとえて表現されることから「系統樹」と呼ばれる。
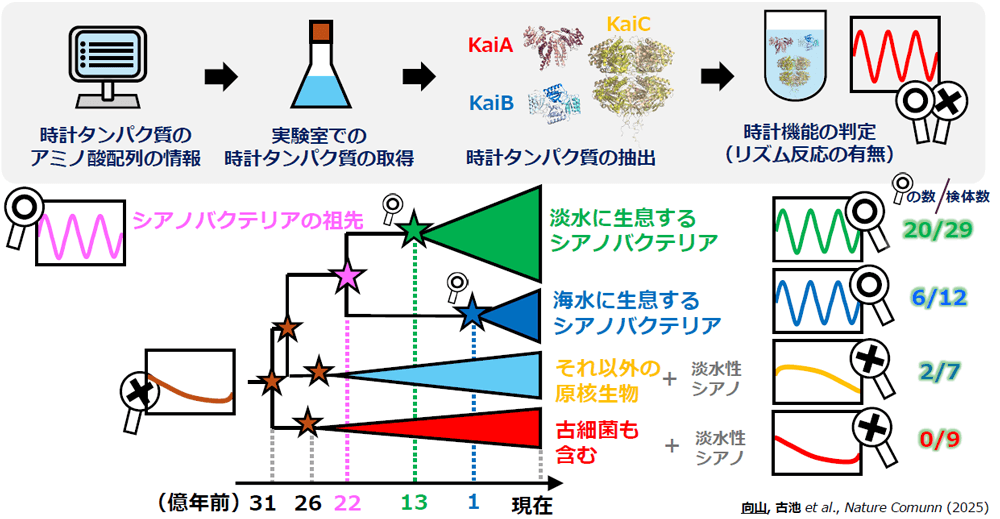
約31億年前、約26億年前、約22億年前、約13億年前、約1億年前の時計タンパク質を再現(星印)、それぞれがリズム反応を示すかどうか検証した。その結果、約22億年前の時計タンパク質(マゼンタの星印)が、最初の体内時計であったことがわかった。
言葉で聞くと簡単だが、得られた結果の信憑性(しんぴょうせい)を高めるために、実際には大量の裏付けデータが必要だった。そこがいちばんの苦労だったという。
「絶滅した祖先のタンパク質については、ある分岐点の再現タンパク質にリズムが確認できたら、当然その下流の現生生物もリズムをもっているはずです。そこで、その下流にいる現生生物のタンパク質も調べていって祖先のタンパク質の再現性を裏付けたんです。説得力を高めるために、結果的に50種類を超えるタンパク質を合成しました。さらに、再現の根拠となる計算のアルゴリズムやパラメーターの条件を変えても結果に大きな影響がないことを確認しました。そうこうするうちに、論文の発表まで10年近くかかってしまいました」
その結果、22億年前の分岐点以降のシアノバクテリアは、体内時計のリズムを刻んだ。そして、その子孫もやはりリズムを刻むことが確認された。しかし、26億年前や31億年前の微生物や、別の系統上にある古細菌などは子孫も含めて時計のリズムを刻むことはできなかった。このことから、生命が最初に体内時計のリズムを獲得したのは22億年前だと確定できた。
アミノ酸配列からの再現とはいえ、試験管で太古の体内時計のリズムが確認できるなんて、思わずワクワクしてしまう。さらに興味深いことに、再現した最古の時計タンパク質の周期は24時間ではなく、18~20時間を示していた。当時の地球の自転周期は研究者によって推定値は異なるものの、20時間程度だったという。自転周期は月からの引力(潮汐力)によって影響を受けている。月は長い年月をかけて地球から離れていっているため、22億年前には、現在より速い周期だったのだ。さらにこのころに、地球の酸素濃度が急上昇したことも知られている。体内時計の誕生と進化は、地球の歴史と重なっているといえるだろう。
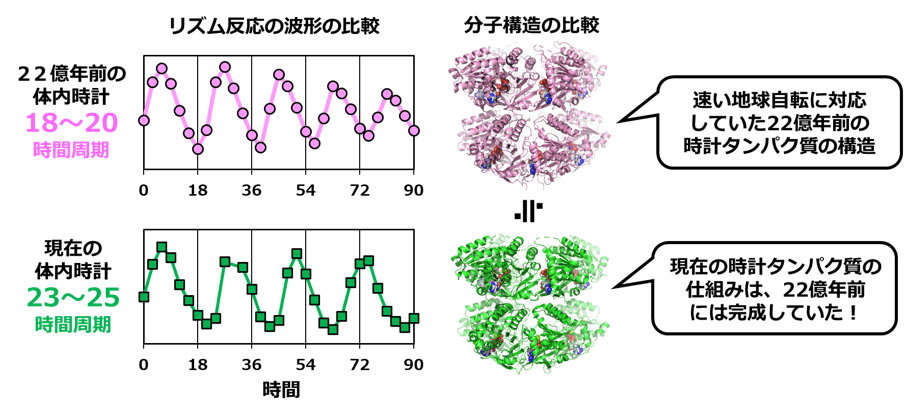
最古の時計タンパク質と現在の時計タンパク質のリズムとかたち
細胞で動く体内時計をこの目で見たい
向山先生たちはシアノバクテリアというシンプルな生物で、体内時計について調べてきた。一方、ヒトを含むほ乳類やショウジョウバエで見つかった時計遺伝子は、シアノバクテリアとはしくみが異なり、KaiCのような24時間周期を生み出すタンパク質はまだ見つかっていない。
ところが、2025年3月、中国の研究グループが、ATPを加水分解する酵素の一つであるRUVBL2が、概日リズムの生成に関与しているとNature誌に発表した。つまり、ほ乳類におけるKaiCにあたるような分子を見つけたというのだ。
「まさに私たちの研究を追随する内容です。リング構造やATPaseの分解速度が極めて遅いといった特徴がKaiCと“似ている”点が、実に興味深いですね。おそらく、真核生物が概日リズムを生み出すには、時計遺伝子の転写・翻訳による振動と、KaiCのような周期を決めるしくみの両方が必要なのだろうと考えています。その謎を解くカギを多くの研究者が探しています。分子の正体が見えてきたら私の出番かもしれません。ぜひ調べてみたいですね」
今回の研究で、シアノバクテリア類の中でも概日時計の時間周期にかなり多様性があることがわかった。向山先生たちは、引き続きその詳細を調べていく予定だ。今回は、既存のデータベースからアミノ酸配列に偏りがないようにデータを集めたが、環境に応じた多様性の進化を調べるなら、昼夜のはっきりしない極域や灼熱の砂漠のバクテリアを調べれば、その関係性がさらにわかるかもしれない。
「いずれにせよ、何を目標に定めるかで物事の捉え方はまったく変わります。試験管の中でリズムを確認することをめざす場合もあるし、分子生物学なら重要な分子を同定するのが目標でしょう。タンパク質研究を生業にしてきた私としては、分子が特定されたところがスタートで、その構造や変化を探ることで本質に迫っていきたい。そして、最終的には細胞の中で実際に動く体内時計を、この目で見てみたいですね」

最後に、読者に向けてメッセージをいただいた。
「私の好きな科目は、昔も今も化学と物理です。生物は決して好きじゃない。他人からは生物学者に見えるかもしれませんが、やっているのは分子の反応や構造を見たり、体内時計のしくみを考えたりすること。つまり化学や物理の延長です。自分がこんな職業に就くとは想像もしていませんでしたが、自分の思いと違うものも取り組んでみたら意外とおもしろくて、回りまわって自分が好きなことにつながっています。中高校生時代、将来の目標を無理に決めなくても、広い視野をもっていろんなことに挑戦すればいいと思います」
生物は好きな科目じゃないと言いつつ、体内時計のしくみを探求してきた向山先生。マウスにもショウジョウバエにも触れずに生命の謎に迫っている。学校の授業は生物、化学、物理と分かれているが、科学の研究は分野をクロスオーバーしながら進んでいく。体内時計の研究も、このように太古の地球環境にまでつながっている。
(2025年12月19日更新)