フクロウ博士の森の教室 シリーズ1 生命科学の基本と再生医療
第23回 iPS細胞を薬づくりに活かす
アルツハイマー病の発症メカニズムの解明と予防・治療法の開発に挑む
長崎大学 医歯薬学総合研究科 岩田修永教授 インタビュー

Profile
岩田修永(いわた・のぶひさ)
1985年東京薬科大学薬学部卒業。90年東京薬科大学大学院薬学研究科薬学専攻博士課程修了。同年国立医薬品食品衛生研究所ポスドク。92-97年東京医科大学医学部助手、95-96年米国国立衛生研究所(NHLBI)血液学部門招聘研究員併任。98年より理化学研究所 脳科学総合研究センター 神経蛋白制御チーム研究員。2003年同チーム副チームリーダー。2010年12月、長崎大学大学院医歯薬学総合研究科 薬品生物工学研究室主任教授に就任。著書に『アルツハイマー病の謎を解く』(共著)など。

───いま、アルツハイマー病の診断はどのように行われているのですか。
アルツハイマー病の診断には、MRI(磁気共鳴画像)やPET(陽電子放射断層撮影)などの診断機器を使って、脳の画像を解析し、脳細胞がどの程度損傷し欠落しているか、アミロイドベータがどれだけ沈着しているか、などを診る診断方法のほか、認知症が疑われる人や高齢者でその心配がある人などに問診によって、記憶力や認識力、判断力などを診る診断方法がとられています。
けれども、たとえばがんの場合であれば、画像診断ではっきりとがん細胞が捉えられればがんと診断することができますが、アルツハイマー病の場合、長い年月をかけて徐々に進行する病気であり、脳の細胞が少なくなって脳が正常な方に比べて小さくなっていることがアルツハイマー病に原因すると断定することやどれだけアミロイドベータがたまればアルツハイマー病を発症するのか、画像診断のみから確定することが難しいという問題があります。
また、「今日は何年の何月、何日ですか」「今いるところはどこですか」などの質問や、簡単な引き算に答えさせる等のテストで、アルツハイマー病などの認知症の発症をすべて断定できるかというとそうも言えません。
それでもMRIやPETから得た画像情報と、記憶力、判断力テストなどを組み合わせて診断しているのが現状と言えます。
───診断がむずかしいということは、発症メカニズムなど、分かっていないことが多いのですか。
その通りです。患者さんが亡くなったあとで脳の組織検査をして初めて確定診断ができるという状況ですし、扱えるのはすでに病気を発症したあとの神経細胞ですから、アルツハイマー病がどのような状態をたどって発症し、進行していくのか、動物実験レベルでは想定できても、ヒトの脳で実際に起きている変化が正確に分からないため、治療や薬づくりが進んでいないのです。そこで私たちは、アルツハイマー病の患者さんの皮膚からiPS細胞を作製し、それから神経細胞を分化させて、患者さんの脳の病態を再現して、発症のメカニズムに迫りたいと考えたわけです。
───具体的にはどのような研究をしたのですか。
アルツハイマー病には、家族歴に関係する遺伝性の「家族性」と、家族歴に関係のない「孤発性」とがあります。私たちは家族性の患者さんと、孤発性の患者さん、そして比較する対照として脳に疾患のない方に協力してもらい、各人の皮膚の細胞からつくったiPS細胞を神経系の細胞に分化させ、培養皿の上でその生化学的な変化や遺伝子の発現の様子を再現・解析しました。
───どんなことが解明されたのですか。
その結果、家族性アルツハイマー病の原因遺伝子の一つであるアミロイド前駆体タンパク質(APP)にAPP-E693Δという変異があると、アミロイドベータ(Aβ)がオリゴマーと呼ばれる凝集体となって神経細胞の内に蓄積し、神経細胞を傷つけるなどしてアルツハイマー病の発症に関係していることを見出しました。そして、この病気がどのような流れで引き起こされるのか、これまでの定説とは異なる「病理の流れ」があることも確認できたのです。
従来は、「アミロイド病理カスケード」といって、まず、アミロイドベータが神経細胞の外にたまり、アルツハイマー病に特有の老人斑を形成、その後、細胞内でタウと呼ばれるタンパク質が過剰にリン酸化して線維の塊になって沈着し、神経細胞同士や脳神経の連絡機能をはたすシナプスの変性や脱落を促すと考えられていました。
しかし、私たちの研究ではこうしたアミロイドカスケードは、すべてのアルツハイマー病にあてはまるものではなく、アミロイドベータが神経細胞の内部に直接たまるタイプがあることが解析されたのです。
しかも、家族性だけでなく孤発性のアルツハイマー病患者さんの場合でも同じように神経細胞の内にアミロイドベータが蓄積するケースがあることが分かってきました。
「森の教室」でもお話ししましたが、このタイプに低濃度のドコサヘキサエン酸(DHA)に効果があることが観察できたことも、今回の成果の一つです。
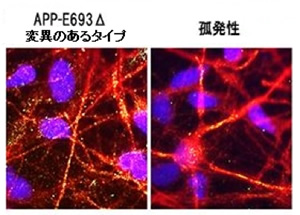
▲神経細胞内に蓄積したAβの様子
黄色い点のように見えるのが、神経細胞内に蓄積したAβオリゴマー(青は細胞の核、赤は神経細胞)。健常人の神経細胞では、黄色い点は検出されなかったという。
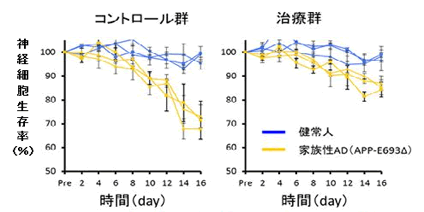
▲iPS細胞から分化誘導した神経細胞の生存解析とDHAによる治療効果
健常人(青色線)ではiPS細胞から分化誘導した神経細胞の細胞死は見られなかったが、APP-E693Δ変異を持つ家族性アルツハイマー病(AD)患者(黄色線)では、2週間程度の培養で細胞死が見られた。適切な量のDHAを添加して培養すると、細胞死が改善された。
───アルツハイマー病の原因となる遺伝子について教えてください。
家族性アルツハイマーは優性遺伝であって、父母のどちらか一方にアルツハイマー病に関係する遺伝子の変異があれば発症します。家族性では遺伝子が強く関係しているので、その遺伝子に変異が起きると、30代や40代など比較的若い年齢でも発症してしまうわけです。
家族性アルツハイマー病に関係する原因遺伝子として知られているのが、先ほどお話したアミロイド前駆体タンパク質(APP)、そして、PS1(プレセニリン1)、PS2(プレセニリン2)の3つです。
アルツハイマーの原因因子とされているアミロイドベータは、APPから切り出されてつくられるのですが、切り出しに関係する酵素がベータセクレターゼとガンマセクレターゼという酵素です。
私たちはAPPを切り出す役割をするベータセクレターゼを阻害する物質もアルツハイマー病の治療薬として有望ではないかと考えています。
───孤発性のアルツハイマーの遺伝子についてはどうなんですか。
孤発性の場合は、アポリポタンパク質E(ApoE)という遺伝子の亜型であるApoE4があると発症率が上昇するといわれていますが、ApE4をもっていても必ず発症するわけでもありませんので、結局はまだ十分に分かっていないというのが現状です。
家族性のアルツハイマー病と孤発性アルツハイマー病を比較すると、遺伝子変異の効果は家族性の方が強く、それだけ研究しやすいのですが、孤発性では、変異効果の弱い遺伝子や発現量が微妙に変化する遺伝子が複数あって初めて発症すると考えられ、その組み合わせを明らかにする研究が遅れていて、手探り状態で研究しているのが現状です。
家族性の原因遺伝子がどのようにアルツハイマー病に関係しているのかが分かれば、孤発性の場合でも家族性と似たようなことが起きている可能性があり、孤発性のメカニズム解析の研究に反映させていくことができるのではないかと考えられます。

