マンガdeひもとく生命科学のいま ドッキン!いのちの不思議調査隊
第22話 システムウイルス学
調査のまとめドッキンレポート
調査のまとめドッキンレポート
コロナ禍で発足したG2P-Japan
新型コロナウイルスによる感染症(COVID-19)が広がり始めたのは2019年12月、中国の武漢からだった。それが2020年春には、アジアやヨーロッパ、アメリカへと拡大し、世界的に大流行。日本でも2月末から学校が一斉休校になり、飲食店が休業して、コンサートなどのイベントが中止になって…と、社会生活が大きな影響を受けたことはみんなもよく覚えていると思う。2023年5月8日からは感染症法上の位置づけが5類に移行して、次第にニュースで見聞きすることは少なくなってきたけれど、いまだに感染者はいるし、後遺症で苦しんでいる人もいる。
コロナ禍で社会が右往左往しているさなかの2021年1月、東京大学医科学研究所の佐藤佳先生が中心となって立ち上げたのがG2P-Japanというコンソーシアム*だ。さまざまな分野の若手研究者が連携し、新型コロナウイルスの遺伝子のデータベースから流行しそうな変異株を見つけ、遺伝子のどこに起きた変異かを解析、ウイルスの性質の変化や流行の規模などをいち早く研究し、査読前論文**の形で公開。そのスピード感で世界的に大きな注目を浴びた。
*G2P-Japanというコンソーシアム:G2Pは、Genotype to Phenotype(遺伝型から表現型へ)といった意味。コンソーシアムは、特定の目的を達成するために、互いに力を合わせて成し遂げようとする組織や人の集団のこと。ラテン語のconsortium(同じ運命を共有するパートナー、仲間)に由来する。
**査読前論文:プレプリントとも呼ばれる。通常論文は、学術誌に投稿された論文を、研究分野に詳しい専門家が読み、追加の実験などの修正を経て掲載となる。こうしたプロセスが「査読」で、掲載に至るまで数カ月~年単位の時間がかかることも珍しくない。パンデミックを引き起こした新型コロナウイルスに関しては、研究成果をスピーディーに発信するため、査読前にウェブサイト上に掲載される論文が増えた。
ウイルスの基本をちょっとおさらい
佐藤先生の研究について紹介する前に、ウイルスについて基本中の基本をまとめておくよ。知っている人は飛ばしてね。
インフルエンザウイルスやノロウイルスなど、名前を聞いたことがあるウイルスはいろいろあると思う。大きさが数十~数百ナノメートル(1ナノメートルは1ミリメートルの100万分の1)と、マイクロメートルオーダーの細菌よりもさらに小さい。細菌もウイルスもどちらも病気の原因になるから似たようなものだと思うかもしれないけれど、大きな違いは、細菌は原核生物で栄養を取り込んで自己増殖できるけど、ウイルスは非生物で、自分では増殖できず他の生物を利用するしかないってことドキ。
増殖のためのシステムがいらないから、ウイルスの構造はとってもシンプル。核酸(DNAまたはRNA)と、それを守るタンパク質の殻があればいい。タンパク質のまわりをさらに「エンベロープ」と呼ばれる膜で保護しているタイプもあり、インフルエンザウイルスやコロナウイルスはこのタイプだ。エンベロープを持たないウイルスの代表例がノロウイルス。
では、他の動物(宿主)に感染するときはどうするか。多くのウイルスは、粘膜や血液から侵入する。そして宿主の細胞の表面にある特定の受容体に結合して細胞内に入り込み、宿主の増殖機能をのっとって増えていくのだ! その過程で、宿主の細胞を変性させるなどさまざまな悪さをする。もちろん宿主にも防御機構はあって、ウイルスとの攻防が続くわけ。
ところで新型コロナウイルスはなぜ「新型」と呼ばれているかというと、一番新しく登場したコロナウイルスだからドキ。これまで知られていたコロナウイルスは6種類。ふつうの風邪の原因となるコロナウイルスが4種類、他の2種類が2002年に中国広東省で発生したSARSコロナウイルスと、2012年にサウジアラビアで発見されたMERSコロナウイルスで、どちらも重症肺炎を引き起こして大騒ぎになったんだよ。
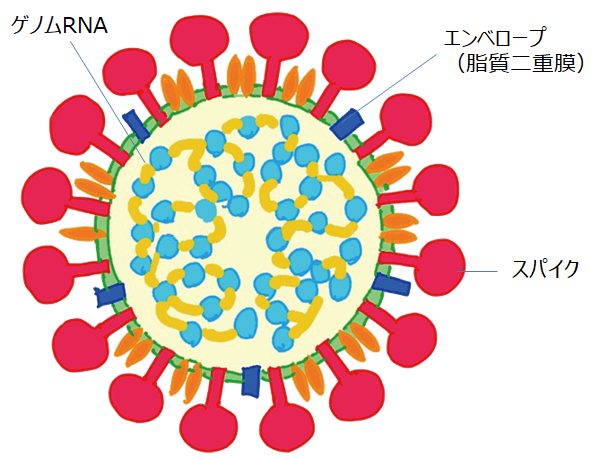
コロナウイルスは直径100ナノメートルの球形で、表面に王冠(ラテン語で「corona(コロナ)」)のようなスパイクを持ち、脂質二重膜のエンベロープの中にタンパク質の殻とゲノムRNAがある。コロナウイルスはスパイクが宿主の細胞の受容体にくっつくことで感染する。
ヒトとウイルスの攻防に関心を持つ
佐藤先生はもともとウイルスの進化に興味があって、大学院では京都大学ウイルス研究所長の小柳義夫(こやなぎ・よしお)教授のもとでAIDS(後天性免疫不全症候群)の研究をしていたんだって。AIDSは、ヒト免疫不全ウイルス(HIV)が血液から侵入し、免疫システムを担う司令塔のヘルパーT細胞に感染して増殖することで発症。5~10年ぐらい経ってからだの免疫機能が働かなくなり(免疫不全)、普通なら免疫システムで排除されてしまう弱い病原体によって、全身に不具合を引き起こす。1981年に初めて発見され、当初は致死率100%の不治の病といわれて恐れられたけれど、その後、抗HIV薬が開発され、今では定期的な投薬をすればAIDSを発症することはなくなったという。
先生が研究を始めたころは、ウイルスの増殖をジャマしようとする宿主側の防御機構と、それに対抗して防御機構をすりぬけようとする(拮抗阻害[きっこうそがい]という)AIDSウイルス側のメカニズムの解明がホットな研究テーマとなっていた時期だった。HIVはヒトとチンパンジーにしか感染しない。そこで先生は、先天的に免疫細胞がないマウスの赤ちゃんにヒトの造血幹細胞を移植して、ヒトの免疫細胞を持つ「ヒト化マウス」をつくりだした。そのマウスに、一部の遺伝子をノックアウト(機能除去)したHIVを接種し、野生型のHIVを接種させたマウスと感染力や病原性がどう違うかを比較し、ウイルスと宿主の攻防を探究してきた。そしてHIVに感染するヒトとチンパンジー、HIVによく似たサル免疫不全ウイルス(SIV)に感染するサルなど、霊長類の進化とウイルスの進化のイタチごっこについて、系統解析*と実験室での検証とを組み合わせてアプローチしてきたんだって。
*系統解析:生物は進化の過程でDNAの構成が変わり、さまざまな種へと分かれてきた。生物のもつDNA配列などの情報をもとに、生物種間の系統関係を明らかにする研究をいう。
2018年には東京大学医科学研究所の准教授に就任。培養細胞や自然界の検体を使ってウイルスの感染実験などを行う「ウェット」の研究だけではなくて、コンピュータを使って遺伝子情報などを解析していくバイオインフォマティクスや、生物の進化を分子構造の変化で探究する分子進化学などの「ドライ」の研究を両輪に、生命科学と情報科学を融合させることで、新しい学問領域を生み出そうと「システムウイルス学」のラボを立ち上げた。COVID-19が猛威をふるいだしたのは、ラボ設立から2年ほど経ったときだった。

「システムウイルス学(SYSTEMS VIROLOGY)」を掲げた佐藤ラボのロゴ。

新型コロナウイルスの研究をスタート
佐藤先生がラボのテーマとして新型コロナウイルスをターゲットにしようと決意したのは、COVID-19が日本で急拡大を始めた2020年3月という。
「世界中がたいへんな事態に見舞われているときに、ウイルス学者として何もしないのは許されないと思いました。コロナウイルスはこれまで扱っていたAIDSウイルスとは性質が大きく違うのですが、これまで身につけた実験手法や解析法が活かせるはずだと考えたのです」
| AIDS | 新型コロナウイルス感染症(COVID-19 | |
| 病原体名 | ヒト免疫不全ウイルス(HIV) | 新型コロナウイルス(SARS-CoV-2) |
| 分類 | RNA型エンベロープウイルス | |
| 発生が確認された年 | 1981年に報告 | 2019年中国武漢市で発見 |
| 侵入時に結合するタンパク質 | CD4受容体 | ACE2受容体 |
| 標的 | 血球細胞 | 呼吸器 |
| 感染経路 | 粘膜(腸管、膣、口腔内など) 血管に達するような皮膚の傷 |
咳、飛沫 |
| 症状 | 免疫不全 | 咳、高熱、肺炎、下痢、味覚障害等 |
| 発症まで | 数年~10年 | 急性感染(1~14日) |
| 自然宿主 | アフリカのサル チンパンジーが感染したSIV(サル免疫不全ウイルス)が起源? |
東アジアや東南アジアに生息するコウモリ? |
戦略はこうだ。新型コロナウイルスとSARSコロナウイルスの遺伝情報を比較すると、配列が大きく異なるORF3bという遺伝子がある。SARSコロナウイルスでは、ORF3bからつくられるタンパク質がインターフェロン*の産生を抑制するという先行研究があった。そこで、ヒトの培養細胞にそれぞれのコロナウイルスのORF3bだけを導入し、つくられるインターフェロンの量を比べれば、重症化しやすいSARSと、健常な人であれば軽症ですむことが多いCOVID-19の病態の違いが説明できるのではないか?
*インターフェロン:異物の侵入に際して宿主細胞により分泌されるタンパク質で、ウイルス増殖の阻止や、免疫系の調節など生体防御の中心的な役割を果たす。
「COVID-19のほうが軽症なので、新型コロナウイルスのORF3bを導入した細胞のほうが、インターフェロンが多くつくられるはずだと予想していました。ところが実験データは仮説とは真逆で、作られたインターフェロンの量は、新型コロナウイルスのORF3bを導入した細胞のほうが、SARSウイルスのORF3bを導入した細胞よりもさらに少なかったのです。この結果をどう読み解くか悩みましたが、私たちは、新型コロナウイルスのORF3bをある型に変異させると、インターフェロンの分泌を抑える効果がさらに高まることを見つけていました。データベースを見ると、この型と同じ変異をORF3bに持った新型コロナウイルスに感染した人が、エクアドルから報告されていた。そこで、そのデータを登録したエクアドルの医師にメールして、『診ていた若い患者2名が重症化し、うち1名が死亡した』という情報を得ました。つまり、ORF3bの変異によってインターフェロンを抑制する効果が増強すること、それがCOVID-19の重症化に関連する可能性があることを報告できたのです」
G2P-Japanの成果
ウイルスの変異が病原性に影響を与えることを示した論文の実績もあり、佐藤先生はAMED(日本医療研究開発機構、エーメドと呼ばれる)が新型コロナウイルス研究推進のために設けた2021年度の大型研究費を獲得した。研究をさらに推進させるために立ち上げたのがG2P-Japanだった。
「日本はCOVID-19の第一波封じ込めには成功しましたが、研究面では惨敗でした。予算もあるし、バイオセーフティレベル(BSL)3*以上の研究設備も100か所以上ある。それなのに研究成果が出ていないのはなぜかというと、研究者が少ないからなんです。当時、私が所属する研究所を含めた多くの研究施設では、『新型コロナウイルスについてBSL-3で実験できるのはポスドク以上』という縛りがあって、うちの研究室でいうと、2020年時点では私を入れて2名で、もう一人は実験をしないバイオインフォマティクスの専門家。大型予算がついても実験できる人が限られてしまう。そこで熊本大、宮崎大、広島大、北大など、専門が異なる各地のメンバーで、基礎研究から臨床研究までを分担して研究すればいいと考えました」
*バイオセーフティレベル3:細菌・ウイルスなどの病原体を取り扱う実験室・施設の分類がバイオセーフティレベル(BSL)で、それぞれ設備基準がある。レベル3は、ヒトあるいは動物に感染すると通常重篤な病気を起こすが、他の個体への感染伝播の可能性が低いもの、または、有効な治療法・予防法がある病原体(たとえば黄熱ウイルス、狂犬病ウイルス、AIDSイルスなど)で、施設の運用・維持管理には相当な知識と技量を要する。
研究の流れを簡単に言うと…。
まず新型コロナウイルスのゲノム配列のデータベースを調べて、登録数の増加スピードや実効再生産数を自動計算し、次に支配的になる可能性の高い変異株を予測する。検体を入手したらメンバーで共有。遺伝子配列から系統を解析する人や、ゲノム情報をもとにウイルスを人工的に合成する人、それを培養細胞やハムスターに感染させてウイルスの病原性を解析する人、タンパク質の構造解析をする人…などと手分けしていく。
それ以降の活躍はすごい。トップジャーナル(一流の科学誌)に論文を連発。2021年1月にスタートしたG2P-Japanは、24年12月末の4年間で49報もの論文を送り出したんだって!
「一番大変だったのはオミクロン株の最初の論文です。デルタ株が収束しつつあるなか、誰も予想していないときに誕生し、あっという間に世界中に流行が広がった変異株でした。2021年11月25日に南アフリカ共和国で『B.1.1.529』という新しい変異株による感染者の出現がWHO(世界保健機関)に報告され、翌日、懸念される変異株*として『オミクロン』と命名され、世界に警鐘が発せられたのです。ホテルに缶詰めになって、メンバーとは毎日のようにオンラインで打合せし、12月25日夜にデルタ株とオミクロン株の病原性が違うメカニズムを示した論文を世界に先駆けて公開しました。出現からわずか1か月でまとめ上げたのです。体力の限界まで出し切っての挑戦でしたが、基礎研究が社会に役立つ実感に、大きなやりがいを感じましたね」
*懸念される変異株(VOC:variant of concern):WHOによる分類で、主に感染性や重篤度が増す、ワクチン効果が減弱するなど、性質が変化した可能性が明らかで、流行拡大が懸念される変異株。
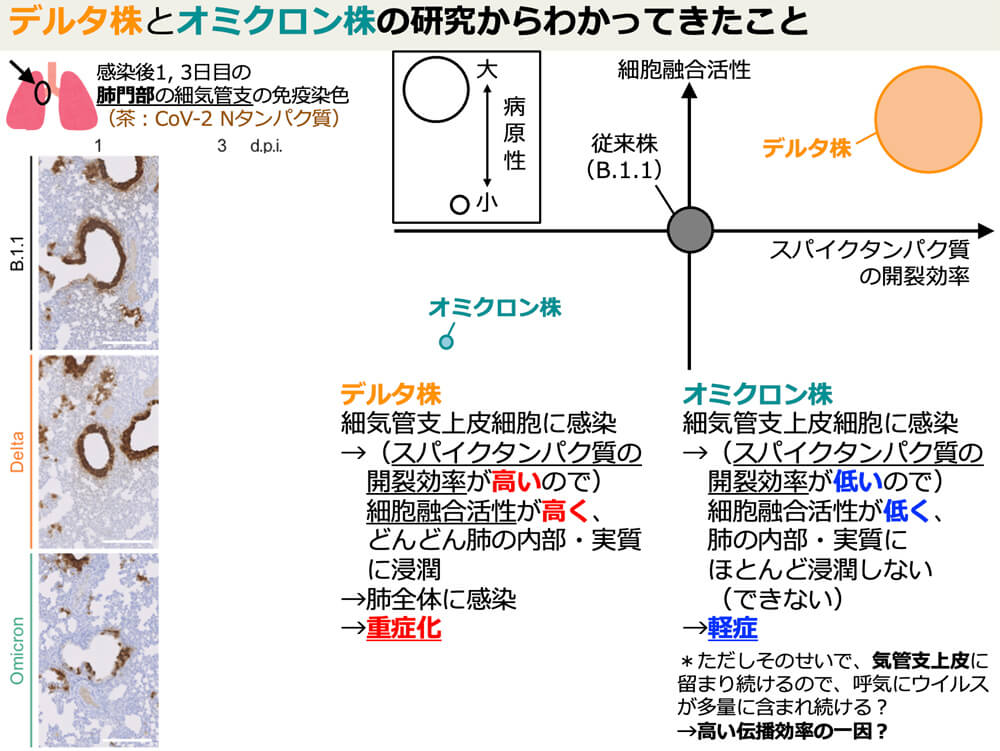
培養細胞を用いた感染実験によって、オミクロン株は、従来株やデルタ株よりも、細胞融合活性(スパイクタンパク質を介して細胞同士が融合する度合い)が低く、その結果、細胞塊がほとんど形成されないので、肺の内部に浸潤しないこと。また、ハムスターを用いた感染実験でも、体重減少や呼吸機能の異常などの症状が起こりにくく、病原性が低いことを明らかにした。
このほか、世界各国のウイルスゲノム情報をもとに、ヒト集団内におけるオミクロン株の増殖率を推定し、オミクロン株のヒト集団での増殖速度はデルタ株に比べて2~5倍高いことを明らかにした。
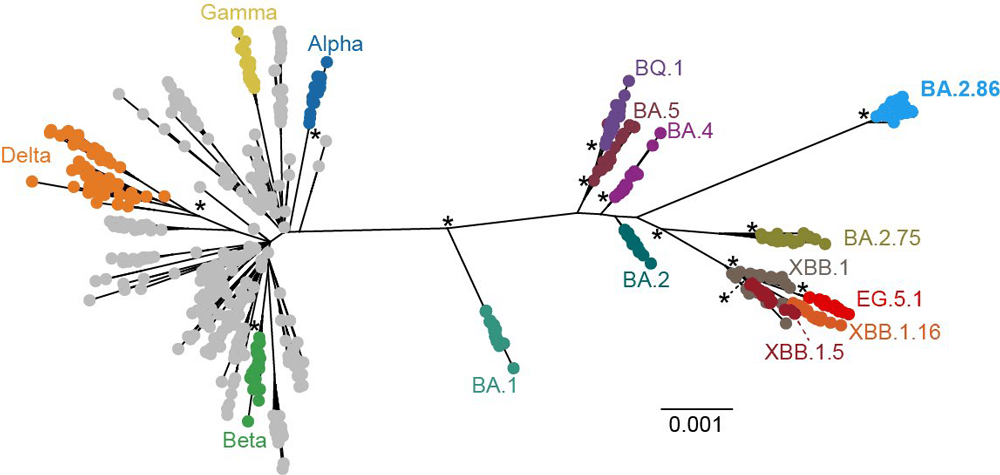
新型コロナウイルスの系統樹。図中「BA.1」より右側のウイルスはすべてオミクロン株。距離が離れているほど変異が大きい。BQ.1は、BA.5から発生した亜系統の1つ。XBBは、2023年3月頃から世界的に流行が始まった、遺伝子組換えによって誕生したオミクロン株の亜系統。EG.5.1はXBBからさらに枝分かれした株。
高校時代のスクラップブック
佐藤先生がウイルスに興味を持ったのは中学生時代。感染すると致死率40%を超える謎のウイルスがアフリカで流行していることをテレビの情報番組で知ったのだ。
「エボラ出血熱のことだったのですが、こんな恐ろしいウイルスが実際にあるのかと衝撃を受けました」
高校時代には、人間の細胞内に存在するミトコンドリアが宿主である人間を乗っ取って暴走するバイオSFの『パラサイト・イヴ』や、映像を見ると死んでしまう「呪いのビデオ」と未知のウイルスの謎に迫るホラー小説『リング』『らせん』、世界を滅亡に追い込んだ殺人ウイルスが登場するマンガ『20世紀少年』などにハマったという。
「当時、新聞記事をスクラップしていたんです。『万能細胞』とか『HIVの起源がわかった』といったニュースが貼ってあって、バイオテクノロジーに興味を持っていたことがよくわかります。高校3年の2000年6月には『ヒトゲノムの解読完了間近』の記事。いよいよ遺伝子で生命科学の謎を解き明かす時代がやってきたと、遺伝子工学やその応用に力を入れている農学部に進学を決めました」
大学2年のとき、仙台病院で開催された「みちのくウイルス塾」に参加し、当時、東北大学医学部教授だった小柳義夫先生と知り合った佐藤先生は、大学院は小柳先生のもとで学ぼうと決意。ところが小柳先生が2004年から京都大学に移ることになったため、佐藤先生も京大の大学院に進学。大学院でHIVをテーマにしたことは最初にふれたとおりだ。

2002年に開催された第1回みちのくウイルス塾のプログラム。
ウイルス研究は実験室の中では終わらない
新型コロナウイルスの変異を追い続ける中で、佐藤先生が実感したことがある。ウイルス研究は、実験室からは始まらないし、実験室内で終わらないということだった。
「謎の病気が社会に広がる。これが感染症かもしれないと疑うことが感染症研究のスタートです。まず感染者がどう広がっていくのかを世界規模で探る疫学(えきがく)*研究が始まります。臨床の現場では感染者を調べどんな症状が起きる病気なのかを探っていく。呼吸器の症状だから呼吸器感染症だろうということが推察され、痰や唾液から病原体を分離して、新型コロナウイルスが見つかる。ウイルスが分離されたら、実験動物に感染させて、症状が再現できるかどうかを調べたり、培養細胞を使った実験ができるようになり、ワクチンや治療薬の研究も進んでいく。でもこれで終わりではなく、ウイルスのゲノムを調べると変異株が出現していることがわかる。変異株に薬が効かなくなると、それがなぜ効かないのかを探らなくちゃならない。そのためには、ウイルスのゲノムの変異がウイルスのタンパク質のどこにどう影響を与えるのかということを理解する必要があって、そうなるとクライオ電子顕微鏡とか、結晶構造解析を用いて変異が入ったタンパク質の構造を理解する必要が出てくる…。こんなふうに、世界規模のイベントから1分子レベルまで、マルチスケールの研究が必要になるんですね。こういう『ウイルスについて全部調べる』ことを目的にした新しい研究を僕たちは『システムウイルス学』と呼んでいて、こういう研究こそこれから必要になってくると考えています」
*疫学:人間集団の中で発生する健康関連のさまざまな事象の頻度や分布(流行状況など)それに影響を与える要因を明らかにして、有効な対策を立案に役立てるための学問
次のパンデミックに備える
今後の大きなテーマは「次のパンデミック(世界的流行)に備えること」と佐藤先生は言う。
アウトブレイク(集団感染)を引き起こす新興感染症のほとんどは、野生動物が「種の壁」を超えてヒトに伝播して病原性を獲得したものだ。HIVは、元来アフリカにすむサルが自然感染していたものが、チンパンジーを経てヒトのAIDSイルスになったと考えられている。新型コロナウイルスも、もともとは中国や東南アジアの洞窟にすむコウモリがよく似たウイルスを持っていて、中間宿主を経て生まれたと言われている。では、種を超えてヒトに伝染するようになるには、どんなファクターが必要なのか?どんな変異を遂げたのか??
また、1918年にスペイン風邪と呼ばれるパンデミックを起こしたのは鳥で、新型コロナウイルスはコウモリだが、鳥やコウモリではウイルスは腸管で増えるのに、ヒトでは呼吸器で増える。なぜ腸から呼吸器へと変化するのだろう?
こうした謎に挑戦するために、佐藤先生は、①ウェットのチームと②ドライのチームに加えて、③フィールドのチームを設けた。
「感染症は発生してからでは遅いんです。だからこそ、実験室から日本や東南アジアなどのフィールドに出かけ、野生動物がどんなウイルスを持っているのか、どんな病原体が今後リスクになりうるかを調べ、ウイルスの異種間伝播の謎に迫りたいと考えています」

ラボを案内してくれた修士1年のMaximilian Stanley YOさん(右)と、ポスドク(博士研究員)の臼井郁(うすい・かおる)さん(左)。Maximilianさんは、センザンコウのコロナウイルスと新型コロナウイルスを比較、ヒトに感染する際の遺伝子変異を探っている。臼井さんは大学院ではコウモリのエコーロケーションの起源の研究をしており、現在は佐藤ラボでコウモリとコウモリを自然宿主とするウイルスの関係について探究を進めている。
「ワンヘルス」という考え方
そもそも、なぜ未知のウイルスが出現するようになったんだろう?
「未知のものって、もともと人間社会との接点がなかったところからやってくるんですね。それが、野生動物だけがすんでいたジャングルなどが開拓され、人間が入り込むことで、自然界との接点ができて害になるものが生まれ、交通の発達もあって一気に広がっていくわけ。
ヒトと動物、それを取り巻く生態系や環境は相互につながっていて、人間社会の安全のためには、ヒトと動物の健康と環境保全・多様性の維持が重要だという考え方を『ワンヘルス』と呼びます。ウイルスと環境保全とは一見関係ないように思うかもしれないけれど、感染症対策にとって非常に大切なんですよ」
ウイルス研究は社会から求められている!
佐藤先生がみんなに知っておいてもらいたいことは何だろう?
「何よりも、感染症研究がいかに社会から求められている研究かを知ってほしいですね。それだけにやりがいが大きい分野です。パソコンが得意な人や野外に出るのが好きな人、創薬や医療に興味がある人、進化に興味がある人、遺伝子の解析や1分子レベルのふるまいに関心がある人から、昆虫や動物に関心がある人まで、それぞれのいろいろな興味からアプローチができます。基礎研究から応用研究まで間口が広く、世界を舞台に活躍できる。ぜひ感染症研究の世界に飛び込んでください」

佐藤ラボのメンバー。ポスドクや大学院生の約3分の1は海外からの留学生。パワーポイントなどでの発表は英語だが、どの言語でもOKのラボミーティングもいつのまにか英語になったという。
ウイルス研究に興味のある人にオススメ
佐藤先生に、ウイルスや感染症研究に興味がある人にオススメの本を教えてもらったドキ。

佐藤 佳・詫摩雅子/著
『G2P-Japanの挑戦 コロナ禍を疾走した研究者たち』
(日経サイエンス 2023年12月刊)
コロナ禍に佐藤先生が中心となって立ち上げたG2P-Japan。そのスタートから、参加した研究者たちの研究内容、メンバーが一丸となって成し遂げた成果を綴ったドキュメンタリー。ウイルス研究者の姿を知ってほしいと全国すべての高等学校に寄贈された。

河岡 義裕/編
『ネオウイルス学-ウイルスと生命、共生と進化の未来を探る!』
(集英社新書 2021年3月刊)
2016年に発足した新学術領域「ネオウイルス学」は、「病原体」としての側面だけでなく、「生態系の構成要素」としての側面にも着目し、ウイルスのすべてを対象に、生物に与えるさまざまな影響やメカニズム、自然界でのウイルスの存在意義を解明しようと、東京大学医科学研究所の河岡義裕教授(現・特任教授)を領域代表者として発足。5年間の研究が終わる節目にまとめられたのが本書。20人の研究者が登場し、ウイルス学、生物学、獣医学、医学、数理学など領域横断的研究の重要性がわかる。第2章に「ウイルスをさまざまな観点から俯瞰的に理解する」と題した佐藤先生担当のページがある。
このほか、書籍ではないけれど、2011年に公開され、新型コロナのパンデミックを予言したといわれる映画『コンテイジョン』もオススメとのこと。コウモリから豚を介して人に伝播し、20世紀末にマレーシアで流行した二パウイルスをモデルにした映画で、感染症が引き起こすパニックがリアルなんだって。
生命科学DOKIDOKI研究室の次の記事も読んでみてね!
-
◎エボラウイルスなどを研究対象とし、ウイルスの一生の可視化に取り組んでいる長崎大学・南保明日香教授によるウイルスの解説
■中高生が第一線の研究者を訪問「これから研究の話をしよう」
第9回 ウイルスの一生を視る -
◎インフルエンザウイルスが重症化するメカニズムを研究する今井由美子先生のインタビュー記事
■この人に聞く「生命に関わる仕事っておもしろいですか?」
第25回 インフルエンザウイルスと宿主の相互作用の秘密に迫る
(取材・文:「生命科学DOKIDOKI研究室」編集 高城佐知子)