フクロウ博士の森の教室 シリーズ2 脳の不思議を考えよう
第5回 認知症と脳
異常タンパク質の脳内での広がり方を探究、認知症研究の新しい方向性を開拓
公益財団法人 東京都医学総合研究所
認知症・高次脳機能研究分野
長谷川成人 分野長 インタビュー

Profile
長谷川成人(はせがわ・まさと)
1986年筑波大学大学院修士課程修了。化学系企業勤務ののち、1988年に東京都老人総合研究所で非常勤職としてアルツハイマー病の研究に携わる。世界で初めてタウのリン酸化部位の同定に成功し博士号を取得。93年東京大学医学部脳研究施設助手。95年英国MRC Labotatory of Molecular Biologyに留学、ミシェル・ゴダート (Michel Goedert)教授に師事。99年東京大学大学院薬学系研究科講師。2001年東京都精神医学総合研究所分子神経生物部門長。2013年より現職。タウ、αシヌクレイン、TDP-43など、細胞内タンパク質の構造異常と神経変性疾患の発症機構解明、治療に関する研究を行っている。

───認知症の研究はいつ頃から、どのようにして始まったのでしょう。
認知症の最大の原因疾患であるアルツハイマー病の研究は、1906年にドイツの精神科医、アロイス・アルツハイマー博士によって、最初の症例報告が行われたことにより始まりました。博士は、被害妄想、物忘れで発症、徐々に日常の家事ができなくなり最後には高度の認知症になって4年5カ月で亡くなった女性患者の脳を調べ、神経細胞の中の異常構造物(神経原線維変化)を発見し、これまでにない脳の病気を疑ったのです。
また、1912年には、ユダヤ人神経学者のフリードリッヒ・レビー博士がパーキンソン病患者の脳幹の神経細胞の中に線維状の構造物を発見、後にレビー小体と名づけられました。これが幻視などの症状が特徴であるレビー小体型認知症につながっていきます。
その後、1960年代に入ると、電子顕微鏡の発達によってより微細な異常病理所見が明らかになり、さらに1980年代から90年代になると生化学が進歩し、異常構造物の成分が特定のタンパク質であることが明らかとなりました。すなわち、アルツハイマー神経原線維変化はタウが、レビー小体はαシヌクレインが蓄積していることが示されました。
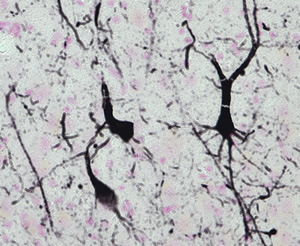
▲ 黒く染まっているのが神経細胞とその突起内の異常型タウ。
───前頭側頭型認知症については、いつごろから明らかになってきたのですか。
1892年にプラハ大学のアーノルド・ピック教授が、前頭葉、側頭葉の明確な萎縮のある患者が言語障害や人格変化を引き起こしている症例を発表、その後ピック病と名づけられ、前頭側頭型認知症のプロトタイプとなりました。
1980年代末から90年代にかけて研究が進み、1994年にスウェーデンのルンド大学とイギリスのマンチェスター大学のグループが取りまとめて前頭側頭型認知症という概念を提唱しました。90年代には前頭側頭型認知症を引き起こすタンパク質としてタウが、2006年にはTDP-43が発見されました。TDP-43は神経難病ALS(筋萎縮性側索硬化症)の原因タンパク質であることも明らかになりました。
───アルツハイマー病の進行機序としては「アミロイド仮説」が有名です。これはどのような説ですか。
アルツハイマー病で亡くなった人の脳を観察すると、前述の神経細胞内の変化に加え、老人斑と呼ばれる凝集物が細胞の外に沈着していて、この老人斑の主成分がアミロイドβです。アミロイドβはその前駆体タンパク質から切り出されるのですが、1991年に遺伝性アルツハイマー病の患者にその遺伝子の異常が発見されたのです。その結果、アミロイドβの蓄積が最初の発症原因であり、アミロイドβの毒性、あるいは二次的な細胞内タウの異常により、神経細胞の変性、脱落が起こって、認知症を発症するという説が唱えられるようになったのです。
しかし、実際の患者脳を調べると、認知機能が正常の場合にもたくさんのアミロイドβの蓄積が認められることや、アミロイドβに先立ってタウの病変が起こっていて、この説では説明できないことも多いのです。
───認知症研究のエポックとなったのは?
一つ目は、亡くなられた実際の患者の脳を詳しく調べることによって、病気の本質的な変化や異常構造物が発見されてきたこと、さらにはその構成タンパク質が同定されたことです。現在、この異常タンパク質の種類や分布の違いなどで、認知症の分類が進められています。
二つ目は、認知症の原因遺伝子やリスク因子の同定でしょう。特定の遺伝子に異常がある場合、ある程度高齢になると認知症になる、あるいは発症リスクが高くなるという分子が発見されたことが挙げられます。
そして三つ目は、認知症に見つかる多くの異常タンパク質が「プリオン」と同じように、正常分子を異常型に変換する能力を持つことで病変が形成、広がることが動物で実証されたことです。
「プリオン」とはクロイツフェルト・ヤコブ病やBSE(牛海綿状脳症、いわゆる狂牛病)の原因物質としてスタンレー・プルシナー博士が提唱した「タンパク性の感染因子」を意味します。博士は、生体内に存在する正常プリオンタンパクを同定するとともに、それが感染性をもつ異常型と接することで異常型プリオンに変化し、病気が発症することを証明してノーベル医学生理学賞を単独受賞しました。
博士は仮説を提唱した当初、ヤコブ病やBSEだけでなく、アルツハイマー病やALSなども同じ考えで説明できると述べていましたが、チンパンジーへの接種実験ではこれらの疾患の発症は確認されず否定されていました。それが、最近、私たちや海外の研究者の研究によって、タウやαシヌクレインなど、アルツハイマー病やレビー小体型認知症の異常型タンパクも、同様のメカニズムで病変が脳内に生じて広がることが証明されたのです。
この考えは、多くの神経疾患に共通し、病気の根本的な進行メカニズムに迫るもので、認知症の研究にとっても革新的なことだと思っています。

