オートファジー研究の広がり
———大隅先生が酵母でオートファジーの重要な遺伝子を発見されて、その後、吉森先生たちが動物で重要な遺伝子を次々に明らかにしてオートファジー研究がブレイクしていったとのことですが、酵母で見つかった遺伝子が動物にもあるということは想定していたんですか?
たぶん、いくつかはあるだろうとは思っていました。なぜかというと、オートファジーはきっと生物にとっての根源的な機能に違いなく、酵母にあるなら動物にもあるだろうと。とはいえ、確信も何もありません。わからないけれど、やってみる値打ちはあるはずだと取り組んで、最初に見つけたのが、大隅先生が酵母で見つけたAtg8という遺伝子の哺乳類のホモログ(進化上、共通の起源をもつ相同性の高い遺伝子配列のこと)であるLC3です。LC3が多段階の翻訳後修飾を受けた後、オートファゴソーム*に特異的に結合することがわかりこれで一気に研究が進みました。つまりLC3は、オートファジーの誘導や抑制を評価するためのマーカーとして使えるんです。2000年にEMBOジャーナルに載ったLC3に関するぼくの論文は、いま被引用数が5000を超えてオートファジー分野では世界第1位です。
*オートファゴソーム:オートファジーの過程で形成される袋状の構造。古くなったタンパク質や病原体、壊れた細胞小器官などをオートファゴソームが包み込んで分解する。
吉森教授のグループは、2013年にオートファゴソームができる様子を独自に作成した蛍光顕微鏡を使って観察し、オートファゴソームが小胞体とミトコンドリアの接触部位から生成されることを明らかにした。
———まさに、大発見!
それと、2004年に細胞内に侵入してくる病原性バクテリアがオートファジーで排除される仕組みも、世界で初めて私が見つけました。このときはすでに独立して国立遺伝学研究所の教授になっていました。手前味噌になりますが、この発見は、単なるリサイクル以上のオートファジーの新しい働き、つまり生体防御機能が見つかったということで、大きな成果だったと思います。
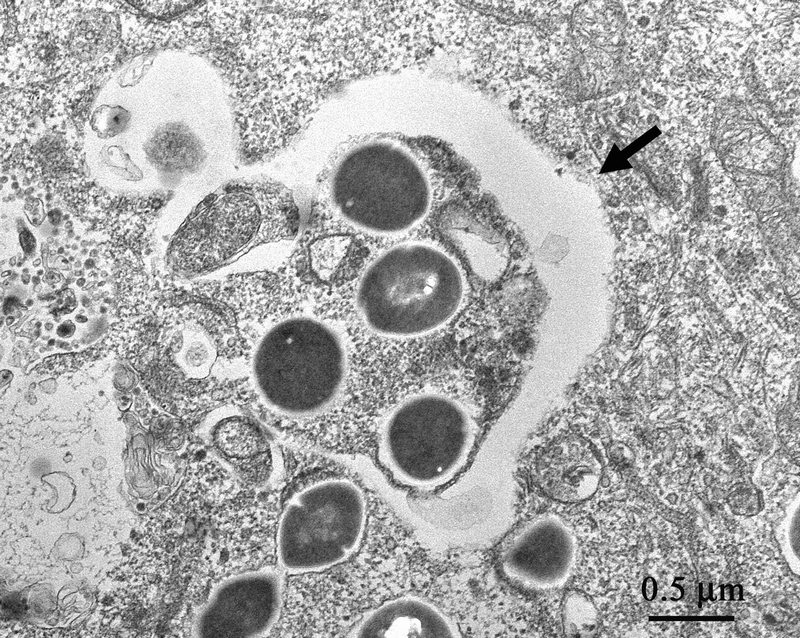
電子顕微鏡で捉えられた病原性バクテリアがオートファジーで排除される様子。細胞質に侵入したA群レンサ球菌を、二重膜のオートファゴソームが包み込んでいる
———こうして、オートファジーの新たな役割が次々に明らかになっていったわけですね。
それまで知られていたオートファジーの役割は、飢餓状態になったときに細胞の中身をオートファジーで分解して栄養源にすること。言ってみれば、足が8本のタコが、飢え死にしてしまうよりはましだと、自分の足を2~3本食べてしまうようなものですね。
———細胞のサバイバル戦略。
でもそれだけだったら、この分野はこれほど大きくならなかった。その後見つかってきたのが、今お話しした有害物の除去機能です。傷ついたミトコンドリアや、神経変性疾患(アルツハイマー病やパーキンソン病等が含まれる)の原因になる凝集したタンパク質、細胞に侵入した病原体などをオートファジーで除去するという役割です。
それともうひとつ重要なのが、細胞の新陳代謝の役割。飢餓状態でなく栄養状態が良くても、オートファジーは毎日少しずつ起こっています。何をしているかというと、細胞の中身を入れ替えている。私たちは毎日食べ物から約70gのタンパク質を摂取してエネルギーにしていますが、それとは別に自己の体タンパク質を成人男性なら1日に約200gも分解しています。このうち70~80%が再びタンパク質の合成に使われているんですよ。
———毎日、壊してはつくることを繰り返しているということですね。いったい何のためですか。
分解するにもエネルギーが必要です。エネルギーを使ってわざわざ分解して、再び同じものをつくる意味は何か? それがナゾだったのですが、オートファジーの働きを止めたら、病気になることがわかったんです。つまり細胞の健康の維持に重要だってことです。
ぼくは講義でよく伊勢神宮の話をするんだけど、パルテノン神殿も伊勢神宮も紀元前からの歴史があるけれど、立派な石造りのパルテノン神殿がボロボロなのに対して、木造の伊勢神宮は式年遷宮で20年ごとに建て替えているからいつもきれいですね。つまり新しくするために壊している。
車だって、10年もすれば中古車ですが、毎日部品をちょっとずつ入れ替えて今日はハンドル、明日はブレーキと交換していたら、数十日で新車になります。細胞はそれをやっている。とくに脳の細胞のように細胞自体の入れ替わりがほとんどない場合は、中身の入れ替えが重要なんですね。
———それって、中身の特定のものを選んで入れ替えているんですか?
栄養をつくるとか、新陳代謝の場合は、相手を選ばすに壊しています。新たにつくるから適当でいいやということで非選択的なんです。
ところが、私が見つけたバクテリアを包み込んで除去する働きは、狙い撃ち。しかも、病原性バクテリアだけじゃなくて、アルツハイマー病やパーキンソン病の原因になるようなタンパク質の塊なども、選択的に排除してくれていることがわかってきました。すなわち、先に述べた有害物の除去は選択的に行われているのです。
———狙い撃ちにするときは、何をターゲットにしているんでしょう?
まだ完全にはわかっていないのですが、バクテリアについては、共通点を見つけました。細胞外から侵入してきた細菌は、エンドソームという膜の袋に入り込みその膜に穴を開けるんですが、その穴を標的にしてオートファジーが起こっていたんです。
———病原菌ではなく、膜に開いた穴が目印だったというのは発想の転換ですね。
それを実証するために、直径数マイクロメートルのポリスチレンの人工ビーズに、膜に穴を開けるような試薬をまぶして細胞に取り込ませたら、まずエンドソームの膜に穴が開きその後見事にオートファジーが起きて、オートファゴソームがビーズを食べちゃったんです!
———実にスマートな実験!
それこそ、研究の醍醐味ですね。ふっと違うことを考えつく。うまくいったときはこたえられません。
———お話をうかがっていると、オートファジーは、本当に私たちの健康にさまざまにかかわっていることがわかります。
いま力を入れているのが、老化との関連です。さきほどオートファジーは新陳代謝の機能を果たしているということをお話しましたが、その機能が老化とともに低下してしまう。それには私たちが見つけた「Rubicon(ルビコン)」というタンパク質が関係していたんです。
ルビコンはオートファジーを抑えるブレーキ役のタンパク質で、これが老化で増えることがわかりました。動物実験でルビコンを抑えると寿命が延びました。それだけではなく運動機能が改善したり、パーキンソン病や腎臓の組織が硬くなる繊維化が抑えられました。つまり加齢に伴うさまざまな症状を抑えることができたんです。生活習慣病の脂肪肝も、ルビコンが増えるせいで起きることを見つけました。興味深いことにルビコンは酵母にはありません。
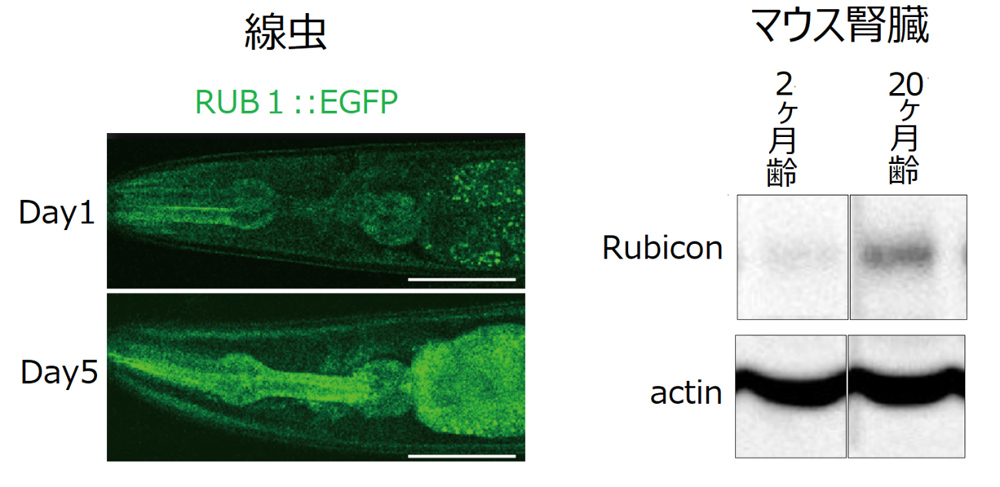
線虫やマウスの腎臓においてRubiconタンパク質は加齢に伴い増加する。
左:線虫の頭部
緑色はRubiconタンパク質を可視化したもの。Day1(上)と比べてDay5(下)ではRubiconタンパク質の量が増加している。
右:マウスの腎臓
マウスの腎臓でも、2ヶ月齢と比較して20ヶ月齢にてRubiconタンパク質の量が増加(Actinは対照群)
Nat. Commun., 10, 847 (2019) から引用
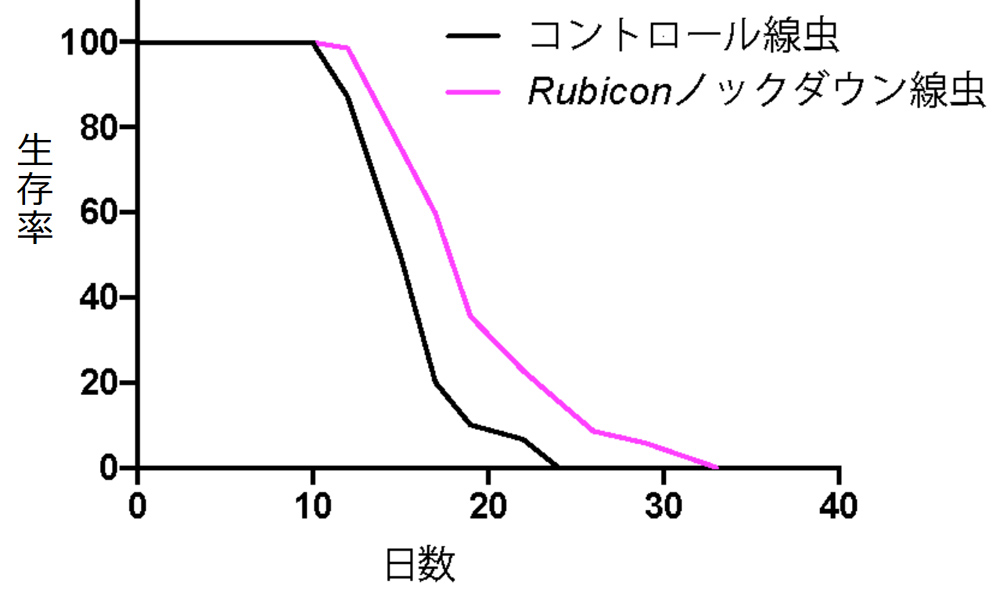
線虫でRubiconをノックダウンすると、コントロール(対照)の線虫と比べて寿命の延長していることがわかる
Nat. Commun., 10, 847 (2019) から引用
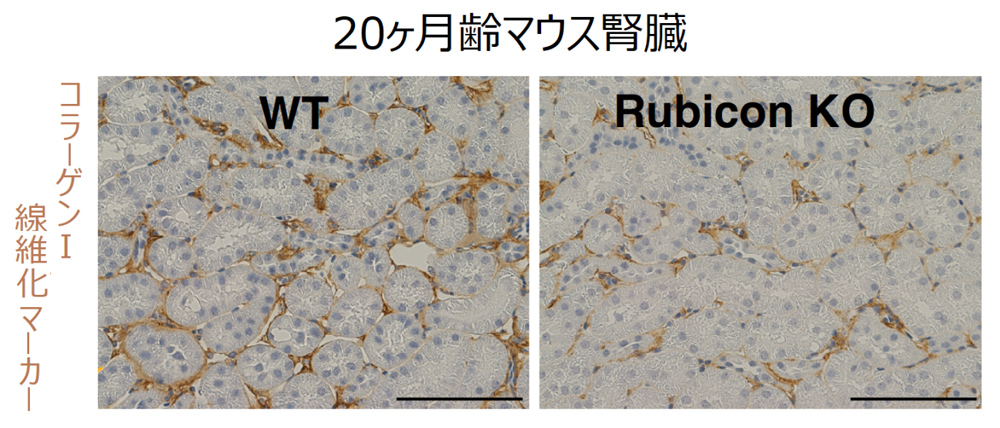
20ヶ月齢のマウスの腎臓を調べると、Rubiconノックアウトマウス(右)では、野生型(左)に比べてコラーゲン(線維化マーカー、茶色)の蓄積が減少する。
Nat. Commun., 10, 847 (2019) から引用
———研究が進めば、加齢性の病気を予防できる可能性もあるかもしれないってことですね?
はい。長寿社会ですから、健康寿命が延びるような薬の開発につながればうれしいですね。特許にも関係しているのであまり詳しくはお話できませんが、応用のためのベンチャーも立ち上げようとしています。科学は文化であって役に立つかわからない研究が尊いと大隅先生がよく言っておられました。まったく同感ですが、私はそういう役に立つか立たないかわからない基礎研究こそが、大きなイノベーションに結びつくことをぜひ証明したいと思っています。