生きた細胞での「クロマチンドメイン」観察に成功
こうして、前島先生はヌクレオソームが不規則に折りたたまれているという‘状況証拠’を次々に積み重ねてきた。
では、ヌクレオソームが不規則に折りたたまれているとすると、どのように分裂期の染色体のようなx字型の構造をスムーズに形成できるのだろうか?
前島先生は、核内に伸び広がった染色体が分裂期になって初めてギューッと凝縮するのではなく、細胞分裂を準備する間期においてもゆるやかな凝縮があり、分裂期にそれがさらに高度に凝縮されるのではないかという仮説を立てた。
「私たちのこれまでのX線による構造解析で、間期のクロマチンと分裂期の染色体は、一部似たようなパターンを示していることが観察されていました。一連の研究から、おそらくDNAは不規則に折りたたまれたあと、なんらかの小さな塊(クロマチンドメイン)を作っているのではないかと推測していました。また、海外のいくつもの研究チームも、私たちとは異なる手法で同じような塊の存在を提唱していました。そこで、なんとかして生きた細胞でクロマチンドメインを観察できないかとチャレンジを続けてきたのです」
その成果が冒頭のニュースである。大阪大学・永井健治教授らとの共同研究で、ヌクレオソーム1分子レベルでの観察ができる「超解像蛍光顕微鏡」を用いた。生きたHeLa細胞を観察し、従来の顕微鏡像よりはるかにクリアで、細部の構造がわかるクロマチンの超解像画像を得ることができたのだ。
「まだヌクレオソームの一つ一つを見ることはできませんが、つぶつぶのクロマチンの塊が確認できました。塊の大きさや性質、分布度合いを定量的に調べるため、空間に配置された物体の分布状況を評価する空間統計学を用いて検討したところ、ヌクレオソームが直径200 ナノメートル程度の塊を形成していること、そしてこれらのクロマチンドメインは細胞周期を通して維持されていて、分裂期の染色体でも存在することがわかりました」
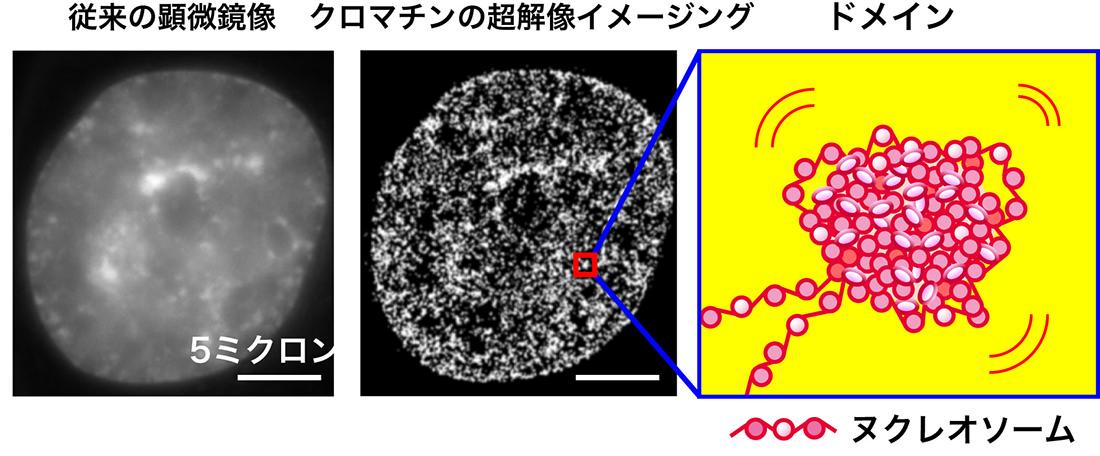
左は従来の生細胞の顕微鏡像(DNAを染色している)。中央は超解像のクロマチン像。細部の構造がよりはっきり観察できる。右はヌクレオソームが集合してできるクロマチンドメインの模式図
さらにクロマチンドメインの形成にあたっては、「コヒーシン」と呼ばれるリング状のタンパク質が塊の維持に重要な働きを示すこと。また、マウスのES細胞の分化の過程でクロマチンドメインの動きが大きく変化することから、クロマチンドメインが転写や複製に密接にかかわり、遺伝子の発現を調整しているのではないかと考えられるという。

「おそらくクロマチンドメインはブロックを形成することでタンパク質のアクセスを調節し、情報検索の制御をしているのではないかと思います。今回のイメージング法をさらにブラッシュアップしていくことで、生きた細胞のなかでクロマチンとタンパク質との相互作用が直接的に観察でき、遺伝子がどのように検索され、遺伝情報が読み出されるかが明らかになっていくはずです」