SLFN11との出会い
———その後、どのように研究を進展させていったのでしょう?
PARP阻害剤で死にやすい細胞と死ににくい細胞があることは気づいていたので、その原因を探っていました。NIHでは、60種類のがん細胞株についてありとあらゆる情報を統合するプロジェクト(NCI-60)が走っていて、その情報を解析したところ、「SLFN11(シュラーフエン・イレブン)」という遺伝子が候補に上がりました。
———それはどんな遺伝子ですか?
SLFN11自体は、Yves教授のラボが「DNAを傷つけるタイプの抗がん剤の作用を左右するのではないか」と、2010年ごろから目をつけて研究を進めていました。でも当時の私は、「DNA修復の研究の歴史は長くて、重要遺伝子はすでに数々見つかっているのに、いまさら抗がん剤の感受性に関係する新しい遺伝子が発見されるなんてことがあるかなあ」と、半ば懐疑的に見ていたんです。
———一般的にもSLFN11の注目度は低かったんですか?
SLFNファミリーのメンバーはSLFN1からSLFN14まで発見されています。そのほとんどが哺乳類のみで見つかりますので、哺乳類で進化した珍しいタイプの遺伝子ファミリーです。SLFN11に関しては、ヒトや霊長類には存在しますが、マウスに同等な遺伝子があるかどうかはまだ不明です。DNA損傷応答に関わる遺伝子は、一般的に酵母からヒトまで共通していることが多いので、SLFN11が注目されていなかったのも無理はありません。Yves教授のラボからSLFN11に関する論文が最初に出たのが2012年ですが、その時点でSLFN11のDNA損傷応答に関する論文はゼロでした。
———それなのに研究しようとした理由は?
CRISPR-Cas9の技術が最初に報告されたのが2013年の8月ぐらいです。私はDT40細胞を使った遺伝子ノックアウト法を身につけていたので、CRISPR-Cas9の論文を読んで「これならSLFN11のノックアウト細胞をヒト細胞で作ることができるな」と思いました。すぐに材料を揃えて実験をスタートし、できたのが2013年の10月1日で、たぶん世界初のSLFN11ノックアウト細胞だったと思います。
その細胞を使ってSLFN11についての実験を始めたところ、たしかに、SLFN11タンパク質のあるなしでPARP阻害剤の効果がまるっきり変わることに気がつきました。肺がんや卵巣がんなど多くのがんで使われる、DNAを傷つけるタイプの抗がん剤(白金製剤やトポイソメラーゼ阻害剤)に対してもはっきりと差が出ました。白金製剤は臨床現場で50年間使われている薬剤ですが、いまだに効くか効かないかの予測因子(バイオマーカー)がありません。SLFN11のあるなしで、細胞の死に方が衝撃的に異なるので、私はSLFN11がきっと医療に役に立つに違いない、研究人生をかけてもいい遺伝子だと確信しました。
———そして、SLFN11が抗がん作用を高める分子メカニズムを発見したわけですね。
当時日本の研究室に戻っていたのですが、SLFN11の研究をするなら、発見場所のNIHですべきだと思い、2015年にNIHに戻りました。SLFN11が抗がん剤の効果を高めることは、2012年以降、さまざまな研究室から続報がありましたが、そのメカニズムは不明でした。私は、紆余曲折を経てSLFN11が抗がん剤の効果を高めるメカニズムにたどり着き、2018年に「モレキュラーセル」という雑誌に論文を発表しました。当時の発表スライドを見返すと、そのころの苦悩の痕跡が残っています(笑)。気がつくと夜中の2時なんてこともありましたし、心からサイエンスに没頭した3年間でした。
———SLFN11の抗がん作用増強メカニズムをわかりやすく教えてください。
がん細胞は増殖するために、活発にDNA複製を繰り返しています。それを逆手にとってDNA複製の邪魔をすればがん細胞を殺すことができます。古くから使われている白金製剤(シスプラチンやカルボプラチン)はこのタイプの抗がん剤です。ところが、シスプラチンを投与しても、患者さんによって効果に差があり、がん細胞が死んでくれないことがあります。いわゆる薬剤抵抗性です。
———DNA複製の邪魔をしても、複製を再開するなんて、がん細胞ってしたたかなんですね。
結局、邪魔されてもいろんな逃げ道を使って複製を完了させてしまうんです。それに対して、がん細胞でSLFN11が発現している場合は、SLFN11タンパク質がDNA複製の複合体にガシッとくっついてしまうため複製がそれ以上進まなくなります。
SLFN11をノックアウトした細胞を詳細に調べると、シスプラチンでいったんはDNA複製が停止するのですが、24時間程度かけてゆっくりと複製を再開するのがわかりました。一方でSLFN11がある細胞では、DNA複製は再開せずに24時間程度で細胞死が起こっていました。つまりSLFN11は一時停止したDNA複製が再開しないようなブロックとして働いているわけです。

SLFN11の機能イメージ。がん細胞のDNA複製はジェットコースターのようなもので、危険を伴いながらもスタート地点まで戻る(複製を完了する)ことができる。抗がん剤でDNAに傷がつくと感知システム(S期チェックポイントという)が働き、コースターはいったん停止する。SLFN11がない細胞では、安全確認の後、コースターは再発進できる(チェックポイントの解除)が、SLFN11(目覚まし時計)がある細胞では、SLFN11がレールを変形させてコースターが再発進できないようにしてしまう。いつまで経ってもスタート地点にコースターが戻れない(複製を完了できない)と細胞は死んでしまう。
———SLFN11タンパク質が複製の邪魔をするのはがん細胞だけですか?
正常細胞でもSLFN11は機能します。ただし、正常細胞の多くは、活発に複製することはないのでSLFN11の影響は受けません。腸管上皮や血液の細胞など、複製する正常細胞でSLFN11が発現していれば、複製を邪魔してしまうかもしれません。正常細胞におけるSLFN11の機能はまだよくわかっていないのです。
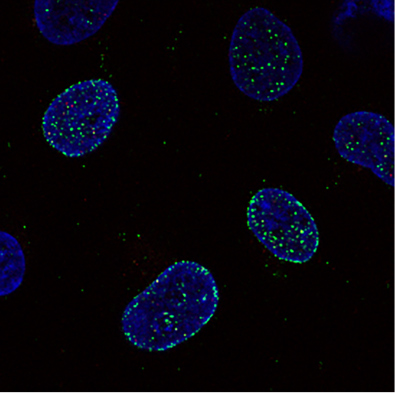
ヒト細胞の蛍光免疫染色による像。抗がん剤(カンプトテシン)の投与によって、SLFN11(緑)がクロマチン(青)上に集積すると、抗がん剤の効果が高まる。
———SLFN11研究の今後の展望は?
SLFN11が本当に臨床現場で役に立つのかどうか、エビデンス(根拠となるデータ)を積み重ねて、結論を出したい。もし役に立つのであれば、一日も早く医療現場で利用できるようにするのが目標です。SLFN11の発現検査は、組織免疫染色法という、安価で一般的に普及している方法でできます。例えば、シスプラチン投与が予定されている患者さんのがん細胞を検査して、SLFN11が陽性なら予定通りに進め、陰性なら別の分子標的薬に切り替えるというように、一人一人の患者さんに合わせた適切な治療を選ぶ一助となることを願っています。
ちなみに、ヒトであればSLFN11の遺伝子自体はゲノム上に全員が持っています。しかし、SLFN11を発現している(タンパク質になっている)がん細胞と、していないがん細胞があり、その制御機構はほとんどわかっていません。その制御機構が明らかになって、SLFN11の発現を高めることができれば、薬剤抵抗性を打破できると考えられるので、制御機構の解明も研究テーマのひとつです。
———臨床応用に向けては共同研究も進行中だそうですか?
慶應大先端研には病院がないので、現在、日本国内の大学病院の先生方と共同研究という形で、臨床検体を含めた研究を進行中です。幸いにも、SLFN11について学会などで発表した際に、興味を示してくださった先生が複数おられて、現在は脳腫瘍、卵巣がん、胃がん、食道がん、頭頸部がん、膀胱がんなどについて共同研究を進めています。今後、臨床検体を用いたエビデンスが蓄積されることで、SLFN11が臨床現場で本当に有用かどうかが判明すると思います。
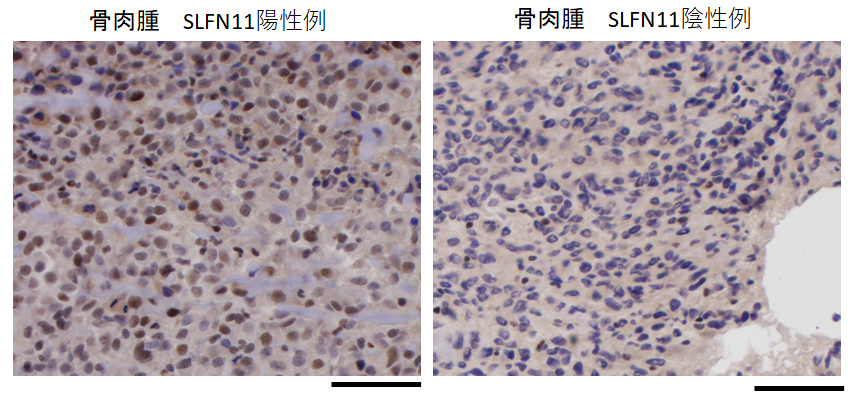
組織免疫染色という一般的な検査方法で、SLFN 11の発現の有無が判別できる。写真ではがん細胞の核を青で、SLFN11を茶色で染めている。SLFN11陽性細胞は核が茶色く染まるが、陰性細胞では核が青いままである。
———そもそもSLFN11って何をしているのですか?
それが謎なのです。
抗がん剤が登場したのはたかだか50年前です。ヒトが進化の過程でSLFN11を獲得したということは、抗がん剤を効きやすくする以外の、もともとの機能があるはずなんですよ。SLFN11がないとこの臓器が不全になるとか、何かのウイルスに感染しやすくなるとか。そういう本来の役割の解明が遅れているのは、モデル動物がないからです。モデル動物の作成はこれからの課題ですね。現時点で言えることは「SLFN11を手に入れた人類は超ラッキー」ということです。
———ところで、先生のところでは地元の高校生も研究に協力しているとか?
慶應大先端研は、研究所のすぐとなりにある県立鶴岡中央高校から、アルバイトとして研究助手を採用する制度があります。私のところには、2019年度は3人の高校生が来てくれて、実験やデータ整理を手伝ってもらいました。すごく真面目な生徒さん達で、授業終了後、平日は毎日のように研究所へ通って、解析装置を使って細胞を判別するセルカウントや実験結果のデータ入力などを分担してくれました。昨年(20年)3月にNIHとの共同研究で論文を発表した際は、謝辞にお名前を入れましたし、地元新聞に写真入りで取り上げてもらいました。
———最後に高校生へのメッセージをお願いします。
「今を生きる」でいいんじゃないかなと思います。目の前にあるやるべきことを全力でやる。部活をやっているなら部活を、勉強好きなら勉強を、何もなければ何か探す努力はしたほうが良いと思います。何もやることがない人生はつまらないですからね。「今を生きる」の積み重ねで自分が形成されていきますので、今を大事にしてください。
(2021年10月7日更新)