次世代シークエンサーでがんと遺伝子変異の関係を次々に解明
———いよいよ、本格的にがん遺伝子とゲノム研究に取り組んでいくわけですね。
最初に取り組んだ研究は、平井先生がライフワークにしていた「骨髄異形成症候群(MDS)*」のゲノム解析です。平井先生はMDSの患者の多くが白血病にかかることに着目して、MDSの段階で白血病に見られる遺伝子変異があることを世界で初めて発見し、1987年にNatureで発表しています。当時のがん研究の最先端研究です。
*骨髄異形成症候群(myelodysplastic syndromes/MDS):造血幹細胞の遺伝子変異によって発症する血液のがんの一つ。血球形態の異常と血球減少によって貧血になり、しばしば急性骨髄性白血病(AML)に進展する難治性の造血器疾患。高齢者を中心に国内において年間3000人~5000人が発症するが、骨髄移植等の造血幹細胞移植以外に根本的な治療手段がない。
———先生もその病気に興味を持たれたのですか?
MDSは難解な病気で興味が持てずにいました。ところが、2003年に平井先生が病で急逝されたのです。研修医時代からの恩師を失って途方に暮れましたが、遺伝子研究の技術やゲノムのデータも整ってきたので先生の遺志を継いでMDSを調べてみようと決めました。その結果、がんに関わる新たな遺伝子変異を数多く同定することができました。
そして、2007年に次世代シークエンサーが登場し、2008年にはヒトの白血病の全遺伝子も解読されました。次世代シークエンサーの成果ですね。東大でも第1号機が2009年に導入されました。
———次世代シークエンサーで何を調べたのですか。
MDSの遺伝子をさらに細かく調べました。そして、MDSでは「RNAスプライシング」というRNA転写のしくみに関わる遺伝子に多くの変異が起きていること、そしてその変異によるRNAスプライシングの異常が、がんの発症に関わっていることを世界で初めて明らかにして、2011年にNatureで発表しました。
———「RNAスプライシング」についてもう少し詳しく教えてください。
RNAスプライシングとは、DNAの塩基情報がRNAに転写されたときに、アミノ酸配列に関係のない部分を取り除いて成熟したmRNAにするしくみのことです。そこに異常があるとタンパク質の合成にも異常が起きてしまうのです。
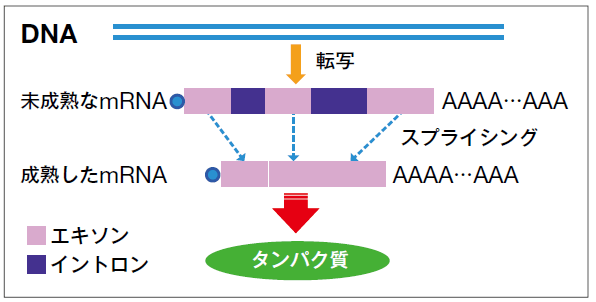
遺伝子のなかでタンパク質をつくるアミノ酸の配列情報をもつ部分が「エキソン」で、もたないのが「イントロン」。遺伝情報の伝達役であるmRNAがつくり出される際に、イントロンが切り取られ残りのエキソンを結合させるのがRNAスプライシング。
RNAスプライシングとがんとの関係は、私も含めて誰も想像していなかったことで、シークエンサーで網羅的な検出ができたからこそ、人間が思いつかない異変に気づくことができたんです。世界中から大きな反響がありました。
ちなみに、その当時、東京大学医科学研究所で情報科学やシステム生物学に取り組んでいた宮野悟(みやの・さとる)先生たちと遺伝子コピー数を解析するソフトウェア「CNAG」も開発しました。これで一気に遺伝子解析のスピードが上がり、多くの研究者に使われることで国際的なネットワークも広がりました。宮野先生とは今でも共同で研究を行っています。
———その後、2013年に京都大学に移られます。
京都大学では、次世代シークエンサーを使ってがんの発症に関わる遺伝子変異を網羅的に調べ始めました。研究に興味を持つ若い先生たちも増えて、次々に新たな遺伝子や変異を見つけてくれました。
2016年には、成人T細胞白血病(ATL)**で、「免疫チェックポイント」の一つ、PD-L1というタンパク質を作る遺伝子に変異を見つけました。ATLは日本で一番多いウイルスによる血液がんですが、ウイルスに感染しても発症する人は5%程度にすぎません。そこで、遺伝子変異が関係するのではないかと調べてみたら、ATLの25%の症例でPD-L1に変異があり免疫細胞の働きを抑えていることがわかりました。
この研究は、特定助教の片岡圭亮(かたおか・けいすけ)君らが中心になって進めてくれ、まずATLの49症例の全ゲノムを解読。さらにがんゲノムアトラスというアメリカのデータベースに登録されている1万例もの症例を解析し、さまざまながんでPD-L1を作る遺伝子の構造に異常があることを発見したのです。
**成人T細胞白血病リンパ腫:ヒトT細胞白血病ウイルス1型(HTLV-1)というウイルスの感染が原因で起こる血液がん。HTLV-1が白血球の1つであるT細胞に感染し、がん化した細胞(ATL細胞)が増殖することで発症する。日本人に多いことが知られているが、HTLV-1に感染しても必ず発症するわけではなく、発症率は約5%。発熱・リンパ節の腫れ・倦怠感・腹痛・下痢などの症状のほか、免疫力が低下することによって正常な人はかからない感染症にかかることがある。
———「免疫チェックポイント」とは何ですか?
病原体などの異物を攻撃するのが免疫反応ですが、これを担う免疫細胞であるT細胞の受容体に結合して、免疫細胞の発動にブレーキをかけるタンパク質です。
がん細胞は、免疫細胞からの攻撃を逃れるために、免疫チェックポイントを活性化させることが知られていて、この働きを阻害して免疫細胞を活性化させてがんを治療しようということで注目されているのが「免疫チェックポイント阻害剤」です。
———京都大学の本庶佑(ほんじょ・たすく)先生が2018年にノーベル賞を受賞された研究ですね。
はい。ところがこの阻害剤の効果が人によってばらつきがあるのが大きな課題になっています。劇的によくなる人がいる一方で、自己免疫反応が起こって命が脅かされるほどの副作用を引き起こす場合もある。
今回の研究で、このようなPD-L1遺伝子のゲノム異常が生じているがんでは、免疫チェックポイント阻害剤による治療が有効である可能性が示唆されました。つまり、この阻害剤(薬)が効くかどうかのマーカーとして役立つ可能性があるということです。
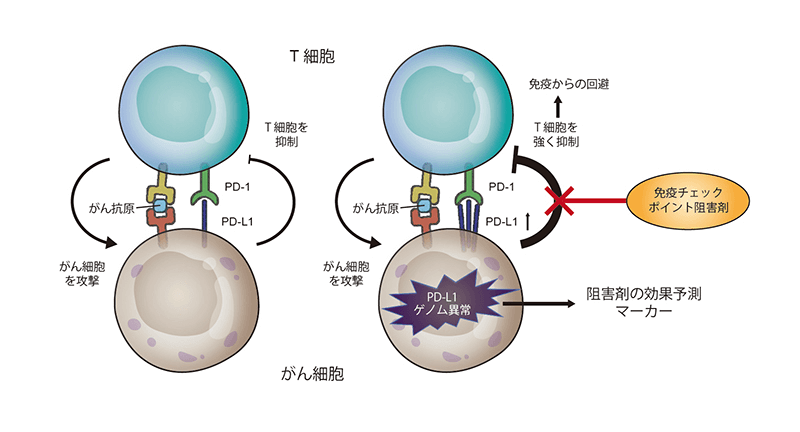
がん細胞のPD-L1と免疫細胞であるT細胞のPD-1受容体が結合すると、がん細胞を攻撃するT細胞の働きが抑制される。がん細胞にPD-L1の変異が起こると、PD-L1が増加してT細胞を強く抑制するため、がん細胞はT細胞からの攻撃を逃れる。PD-L1のゲノム異常を調べることで免疫チェックポイント阻害剤の効果を予測する目印になる可能性がある。