初めての構造解析がNature誌の表紙を飾る!
———チャネルロドプシンの構造解析の研究は、スムーズに進んだのですか?
ハードルだらけだったんですよ。まず、タンパク質は化学合成できないので、大腸菌など扱いやすい生き物につくらせる必要がありますが、チャネルロドプシンがまったく発現しなかったんです。ヒトと大腸菌のように離れた生物種では、同じようにタンパク質が発現しないことがよくあるんですね。それまで濡木研では、膜タンパク質の発現には増殖スピードが速く、培地も安価な大腸菌しか使っていませんでした。そこで、酵母とか哺乳類の培養細胞、あるいは昆虫の細胞ならロドプシンが発現するのではないかといろいろ試し、結局、発現方法を確立するのに1年近くもかかりました。
次に、発現させたタンパク質を大量に集めて精製して解析用の結晶をつくります。チャネルロドプシンのような膜タンパク質には、「X線結晶構造解析*」という手法が使われますが、これもなかなか難しいんです。なぜなら、膜タンパク質は細胞膜にしか発現しないこともあって発現量がとても少ない。しかも膜に埋もれている部分が疎水性で、出ている部分は親水性なので、細胞膜からそのまま抽出すると疎水性の部分が細胞膜外の水分にさらされて不安定になります。そこで、水になじみやすい親水基と油になじみやすい疎水基を持つ界面活性剤で膜タンパク質を保護するんですが、今度は界面活性剤が結晶化のじゃまをして、きれいな結晶ができないんです。
*X線結晶構造解析:生体高分子の立体構造を明らかにする手段の一つ。分子が三次元的に規則正しく並んだタンパク質結晶にX線を当て、得られたデータから原子レベルの構造を決定する手法で、解析にあたっては、タンパク質を精製し結晶化したサンプルが重要になる。
———結晶をつくるのも一筋縄ではいかないのですね…
結晶化には蒸気拡散法という方法を使っていましたが、いろいろな論文を見返してみると、どうやら微生物由来のロドプシンでは、脂質と水溶液を混合した相の中にタンパク質を入れる「脂質キュービック相法」という方法で成功した例が多いらしい。そこで、先輩と京都大学の岩田想(いわた・そう)先生の研究室を訪ねて、その手法を教わりました。すると、ようやく小さい結晶が出てきたんです。これでいけるとホッとしました。
ところが、脂質キュービック法でつくった結晶はすごく小さいために、X線の焦点が絞りきれないんです。スリットを使ってX線を細くすると、今度はX線の強度が落ちてしまう。でも、ちょうどそういうタイミングで、国の大型放射光施設「SPring-8」に非常に細く強いX線が使えるビームラインが造られたんです。そこにいってデータ測定を行い、非常に高い分解能で解析に成功しました。
———チャネルロドプシンの構造を明らかにしようと研究を進めていたライバルも多かったのでは?
いくつかの競争相手に関しては噂がいろいろ入ってきていて、当時、かなり追い詰められていた部分もあったんです。とくに、膜タンパク質の構造解析で1988年にノーベル化学賞を受賞したドイツ・マックスプランク研究所のハルトムート・ミヒェル(Hartmut Michel)博士が率いる研究チームがいいところまで行っているという話を耳にしたときは、かなりのストレスで苦しい思いをしました。
チャネルロドプシンの構造を解明し、光が当たるとイオンを通すメカニズムについてまとめた論文は、2012年に国際的な科学雑誌『Nature』に掲載されました。その構造図が表紙になったのです。チャネルロドプシンと格闘して3年、顕微鏡でオレンジ色の結晶を見たときの感動は今でも忘れません。これまでの研究人生で最高の瞬間でしたね。
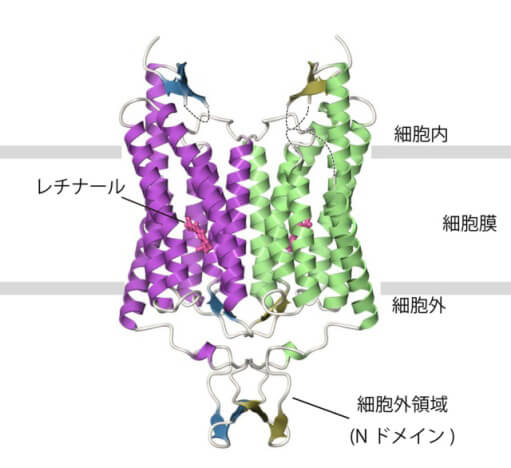
チャネルロドプシンは、アミノ末端側に大きな細胞外領域「Nドメイン」を持ち、二量体構造を形成している。図中のレチナールは、光を受けて活性化する発色団。
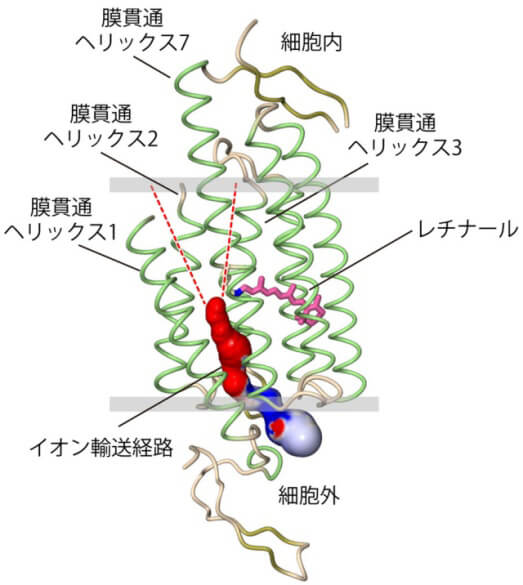
チャネルロドプシンには、7つの膜貫通ヘリックス(アミノ酸がらせん状に結合した構造)を持つ。1、2、3、7番目のヘリックスの間の大きな空間は強い負電荷を帯びており、正電荷を帯びている陽イオンを透過する輸送経路として働いていると考えられる。

学会でハワイへ。2013年(左から2番目)

学位授与式。理学系研究科総代として賞状受領。2014年(壇上モニター右)